Реакция нейтрализации
1. Реакция нейтрализации
Если смешать одинаковые количества соляной кислоты и гидроксида натрия, то образуется раствор, в котором среда будет нейтральной, т.е. в нем не будет присутствовать ни кислота, ни щелочь. Запишем уравнение реакции между соляной кислотой и гидроксидом натрия, если в результате образуются хлорид натрия и вода.
При взаимодействии 1 моль хлороводорода (HCl) и 1 моль гидроксида натрия (NaOH) образуется 1 моль хлорида натрия (NaCl) и 1 моль воды (Н2О). Обратите внимание, в процессе данной реакции два сложных вещества обмениваются своими составными частями и образуются два новых сложных вещества:
NaOH+HCl=NaCl+H2O
Реакции, в ходе которых два сложных вещества обмениваются своими составными частями, называют реакциями обмена.
Частный случай реакции обмена – реакция нейтрализации.
Реакция нейтрализации - это взаимодействие кислоты с основанием.
Схема реакции нейтрализации: ОСНОВАНИЕ + КИСЛОТА = СОЛЬ + ВОДА
Нерастворимые в воде основания тоже могут растворяться в растворах кислот. В результате этих реакций образуются соли и вода. Уравнение реакции взаимодействия гидроксида меди (II) с серной кислотой:
Cu(OH)2+H2SO4= CuSO4+ 2H2O
Вещество с химической формулой CuSO4 относится к классу солей. Формулу этой соли мы составили, зная, что валентность меди в данном процессе равна II, и валентность SO4 тоже равна II. А вот как назвать это вещество?
2. Составление формул и названий солей
Название соли состоит из двух слов: первое слово – название кислотного остатка (эти названия приведены в таблице в учебнике, их надо выучить), а второе слово – название металла. Если валентность металла переменная, то она указывается в скобках.
Итак, вещество с химической формулой CuSO4 называется сульфат меди(II).
NaNO3 – нитрат натрия;
K3PO4 – фосфат (ортофосфат) калия.
А теперь, выполним обратное задание: составим формулу соли по ее названию. Составим формулы следующих солей: сульфата натрия; карбоната магния; нитрата кальция.
Чтобы правильно составить формулу соли, сначала запишем символ металла и формулу кислотного остатка, сверху укажем их валентности. Найдем НОК значений валентностей. Разделив НОК на каждое из значений валентности, найдем число атомов металла и число кислотных остатков.
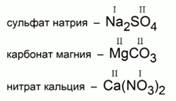
Рис. 1. Формулы следующих солей: сульфата натрия; карбоната магния; нитрата кальция.
Обратите внимание, что если кислотный остаток состоит из группы атомов, то при написании формулы соли формула кислотного остатка записывается в скобках, а число кислотных остатков обозначается за скобкой соответствующим индексом.
