Зависимость давления насыщенного пара от температуры. Кипение
1. Насыщенный пар
На предыдущих уроках мы ввели понятие идеального газа в качестве модели, в рамках которой справедливы все газовые законы, которые мы изучали. Однако это не означает, что молекулярная физика и, в частности, молекулярно-кинетическая теория ограничивается изучением только идеальных газов. Для реальных газов наши выкладки по теме «основы молекулярно-кинетической теории», конечно же, являются справедливыми. Однако связь параметров реальных газов между собой ожидаемо имеет несколько другой вид, нежели эта связь для идеальных газов.
Рассмотрим такой реальный газ, как насыщенный пар. Напомним, что просто паром по умолчанию называется газообразное состояние некоего вещества (чаще всего, говоря «пар», подразумевают именно водяной пар). Насыщенный же пар означает следующее:
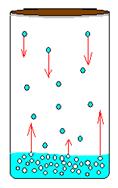
Определение. Насыщенный пар – пар, находящийся в динамическом равновесии со своей жидкостью. То есть количество молекул жидкости, покидающих жидкость за некий отрезок времени, в среднем равно количеству молекул пара, возвращающихся обратно в жидкость (см. рис. 1). Область насыщенного пара всегда есть над любой поверхностью жидкости. Чтобы создать более широкую область, следует предотвратить утечку молекул пара в окружающую среду (герметично закрыть сосуд).
Рис. 1
Для понимания отличий насыщенного пара от идеального газа нужно представить себе два опыта.
Во-первых, возьмём герметично закрытый сосуд с водой и начнём его нагревать. С увеличением температуры молекулы жидкости будут иметь всё большую кинетическую энергию, и всё большее количество молекул сможет вырваться из жидкости (см. рис. 2), следовательно, будет расти концентрация пара и, следовательно, его давление. Итак, первое положение:

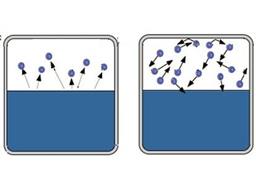
Т1 Т2
Рис. 2. Т2 > T1
Однако, это положение вполне ожидаемо и не столь интересно, как следующее. Если поместить жидкость с её насыщенным паром под подвижный поршень и начать этот поршень опускать, то, несомненно, концентрация насыщенного пара увеличится из-за уменьшения объёма. Однако через некоторое время пар перейдёт с жидкостью к новому динамическому равновесию путём конденсации лишнего количества пара, и давление в конце концов не поменяется. Второе положение теории насыщенного пара:

Теперь же следует отметить тот факт, что давление насыщенного пара хоть и зависит от температуры, как и идеальный газ, но характер этой зависимости несколько иной. Дело в том, что, как мы знаем из основного уравнения МКТ, давление газа зависит как от температуры, так и от концентрации газа. И поэтому давление насыщенного пара зависит от температуры нелинейно до тех пор, пока увеличивается концентрация пара, то есть пока вся жидкость не испарится. На приведённом ниже графике (рис. 3) показан характер зависимости давления насыщенного пара от температуры,
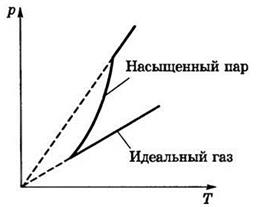
Рис. 3
причём переход от нелинейного участка к линейному как раз и означает точку испарения всей жидкости. Так как давление насыщенного газа зависит только от температуры, возможно абсолютно однозначно установить, какое будет давление насыщенного пара при заданной температуре. Эти соотношения (а также значения плотности насыщенного пара) занесены в специальную таблицу.
Обратим теперь наше внимание на такой важный физический процесс, как кипение. В восьмом классе уже давалось определение кипению как процессу парообразования более интенсивному, нежели испарение. Теперь же мы несколько дополним это понятие.
2. Кипение
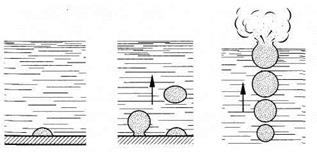
Определение. Кипение – процесс парообразования, протекающий по всему объёму жидкости. Каков же механизм кипения? Дело в том, что в воде всегда есть растворённый воздух, а в результате увеличения температуры его растворимость уменьшается, и образуются микропузырьки. Так как дно и стенки сосуда не идеально гладкие, эти пузырьки цепляются за неровности внутренней стороны сосуда. Теперь раздел вода-воздух существует не только у поверхности воды, но и внутри объёма воды, и в пузырьки начинают переходить молекулы воды. Таким образом, внутри пузырьков появляется насыщенный пар. Далее эти пузырьки начинают всплывать, увеличиваясь в объёме и принимая большее количество молекул воды внутрь себя, а у поверхности лопаются, выбрасывая насыщенный пар в окружающую среду (рис. 4).
Рис. 4. Процесс кипения
Условием же образования и всплытия этих пузырьков является следующее неравенство: давление насыщенного пара должно быть больше или равняться атмосферному давлению.
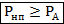
Таким образом, так как давление насыщенного пара зависит от температуры, температура кипения определяется давлением окружающей среды: чем оно меньше, тем при более низкой температуре закипает жидкость, и наоборот.