Закономерности изменения электроотрицательности элементов в группе и периоде
1. Закономерности изменений значений электроотрицательности в периоде
Закономерности изменений значений относительной электроотрицательности в периоде
Рассмотрим на примере элементов второго периода, закономерности изменений значений их относительной электроотрицательности. Рис.1.
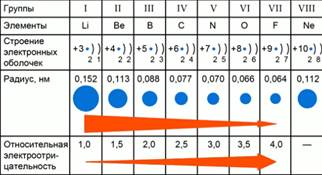
Рис. 1. Закономерности изменений значений электроотрицательности элементов 2 периода
Относительная электроотрицательность химического элемента зависит от заряда ядра и от радиуса атома. Во втором периоде находятся элементы: Li, Be, B, C, N, O, F, Ne. От лития до фтора увеличивается заряд ядра и количество внешних электронов. Число электронных слоев остается неизменным. Значит, сила притяжения внешних электронов к ядру будет возрастать, и атом будет как бы сжиматься. Радиус атома от лития до фтора будет уменьшаться. Чем меньше радиус атома, тем сильнее внешние электроны притягиваются к ядру, а значит больше значение относительной электроотрицательности.
В периоде с увеличением заряда ядра радиус атома уменьшается, а значение относительной электроотрицательности увеличивается.
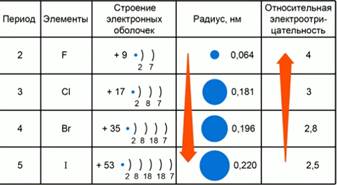
Рис. 2. Закономерности изменений значений электроотрицательности элементов VII-A группы.
2. Закономерности изменений значений электроотрицательности в группе
Закономерности изменений значений относительной электроотрицательности в главных подгруппах
Рассмотрим закономерности изменений значений относительной электроотрицательности в главных подгруппах на примере элементов VII-A группы. Рис.2. В седьмой группе главной подгруппе расположены галогены: F, Cl, Br, I, At. На внешнем электроном слое у этих элементов одинаковое число электронов – 7. С возрастанием заряда ядра атома при переходе от периода к периоду, увеличивается число электронных слоев, а значит, увеличивается атомный радиус. Чем меньше радиус атома, тем больше значение электроотрицательности.
В главной подгруппе с увеличением заряда ядра атома радиус атома увеличивается, а значение относительной электроотрицательности уменьшается.
Так как химический элемент фтор расположен в правом верхнем углу Периодической системы Д.И.Менделеева его значение относительной электроотрицательности будет максимальным и численно равным 4.
Вывод: Относительная электроотрицательность увеличивается с уменьшением радиуса атома.
В периодах с увеличением заряда ядра атома электроотрицательность увеличивается.
В главных подгруппах с увеличением заряда ядра атома относительная электроотрицательность химического элемента уменьшается. Самый электроотрицательный химический элемент – это фтор, так как он расположен в правом верхнем углу Периодической системы Д.И.Менделеева.
Подведение итога
Вы узнали о закономерностях изменения электроотрицательности элементов в группе и периоде. На нём вы рассмотрели, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучили закономерности изменения электроотрицательности элемента.
