Ковалентная полярная связь
1. Введение понятия ковалентной полярной связи
Тема сегодняшнего урока «Ковалентная полярная связь». На прошлом уроке вы познакомились с моделью химической связи, которая реализуется в простых веществах-неметаллах. Такой вид связи называется «ковалентная неполярная связь».
Сегодня вы узнаете о другом виде ковалентной связи, которая образует молекулы сложных веществ.
2. Ковалентная полярная связь в молекуле хлороводорода
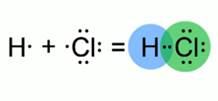
Рис. 1. Образование молекулы хлороводорода
Зная, что ковалентная связь образуется за счет общих электронных пар, изобразим модель молекулы хлороводорода. Атом водорода имеет на внешнем электронном слое всего один электрон. Атом хлора – семь электронов. Эти атомы приобретут энергетически выгодное состояние, если атому водорода будет принадлежать два электрона, а атому хлора – восемь. Такое возможно при образовании одной общей электронной пары.
Связь, образующаяся между водородом и хлором, в молекуле хлороводорода отличается от той химической связи, которая реализуется в молекулах простых веществ водорода и хлора. Это подтверждают экспериментальные данные. Например: атом водорода в молекуле HCl, может замещаться на атомы металла, а раствор хлороводорода в воде проводит электрический ток.
2HCl + Zn = ZnCl2 + H2↑
Электроотрицательность
Атомы разных химических элементов обладают различной способностью притягивать к себе электроны.
3. Шкала электроотрицательности
Способность атома оттягивать к себе электроны, участвующие в образовании связи, называется электроотрицательностью.

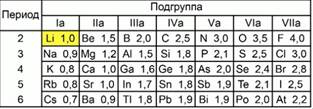
Рис. 2. Шкала относительной электроотрицательности элементов
Лайнус Полинг предложил шкалу значений относительной электроотрицательности, приняв электроотрицательность лития за единицу.
При этом он сравнивал электроотрицательность остальных атомов в химических элементах с электроотрицательностью лития. Максимальную электроотрицательность имеет атом фтора, ее значение равно 4.
В соответствии с этой шкалой, относительная электроотрицательность водорода меньше, чем значение относительной электроотрицательности хлора.
![]()
Рис. 3. Частичные заряды атомов в молекуле хлороводорода
Значит, общая электронная пара, и электронная плотность будут смещены к атому хлора. Обратите внимание на то, что нет полного перехода электрона от атома водорода к атому хлора, а лишь смещается электронная плотность в сторону более электроотрицательного элемента.
Таким образом, на атомах этих элементов образуются частичные заряды, которые обозначаются греческой буквой «δ». На атоме водорода δ+, на атоме хлора δ-.Рис.3.
4. Ковалентная полярная связь в молекулах
Химическую связь, образованную элементами-неметаллами с разной электроотрицательностью, называют ковалентной полярной связью.
Теперь, зная модель химической связи в молекуле хлороводорода, мы можем объяснить, почему раствор хлороводорода в воде становится электропроводным. Откуда там берутся заряженные частицы? Дело в том, что под действием молекул воды образуются не частичные, а целочисленные заряды на атомах H и Cl. Таким образом, в раствор переходят заряженные частицы – ионы, и такой раствор способен проводить электрический ток.
Между атомами неметаллов образуется ковалентная связь. Ковалентная неполярная связь образуется между атомами одного химического элемента. Ковалентная полярная связь образуется между различными атомами неметаллов. При образовании ковалентной полярной связи общие электронной пары смещаются в сторону наиболее электроотрицательного элемента.
Подведение итога
Вы рассмотрели модель образования ковалентной полярной связи в молекулах сложных веществ. На следующем уроке вы узнаете, как изменяются значения относительной электроотрицательности элементов в главных подгруппах и периодах.
