Геометрия молекул. Понятие о теории гибридизации
1. Основное и возбужденное состояние атома углерода
Внешний уровень атома углерода в основном (невозбужденном) состоянии описывается формулой 2s22p2 или схемой:
|
¯ |
|
|
|
|
|
2s |
|
|
2p |
|
В этом строении заложены предпосылки для своеобразной симметрии – для четырех электронов имеются как раз 4 орбитали. Еще в середине XIX века немецкий ученый Фридрих Кекуле справедливо предположил, что в органических соединениях валентность углерода равна четырем.
С точки зрения электронного строения атома это можно объяснить так:
Один электрон с 2s-орбитали «перескакивает» на 2p-орбиталь, атом углерода при этом переходит в так называемое возбужденное состояние:
Возбужденное состояние атома углерода 2s12p3:
|
|
|
|
|
|
|
2s |
|
|
2p |
|
позволяет атому углерода образовать 4 ковалентные связи по обменному механизму.
2. Гибридизация
Три p-орбитали традиционно изображают в форме взаимно перпендикулярных друг другу «гантелей», а s-орбиталь – в форме шара. Три связи, образованные p-электронами, должны располагаться под углом 90o друг к другу, и они значительно длиннее, чем связь, образованная s-электроном. Но метан СН4 – это симметричный тетраэдр.
Еще в 1874 г., за много лет до того, как стало возможным прямое определение строения молекул, Якоб Генрик Вант-Гофф (1852–1911), будучи студентом Утрехтского университета, предположил, что атом углерода в соединениях имеет тетраэдрическое строение. Строение молекулы метана СН4 – правильный тетраэдр с атомом углерода в центре. Валентные углы связей Н-С-Н равны 109о28’.
Упрощенное объяснение: все орбитали внешнего уровня углерода выравниваются по энергии и форме, смешиваются, т.е. «гибридизуются», образуя одинаковые гибридные орбитали. См. рис. 1.
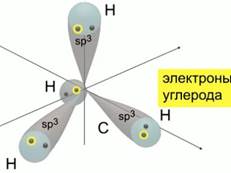
Рис. 1. Гибридизация – это смешивание электронных облаков при образовании химических связей
3. Пространственное строение молекул с разным видом гибридизации
Смешение одной s-орбитали и трех p-орбиталей дает четыре sp3-гибридные орбитали, вытянутые по углам тетраэдра с атомом С в центре. Углерод в метане находится в состоянии sp3-гибридизации. Рис. 2.
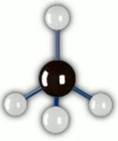
Рис. 2. Строение метана
Строение аммиака
Таким же образом гибридизуются четыре орбитали атома азота в молекуле аммиака NH3: У атома азота 5 электронов на внешнем уровне. Поэтому на одной sp3-орбитали расположена неподеленная пара электронов, а на остальных трех – электронные пары связей N-H. Все четыре электронные пары располагаются по углам искаженного тетраэдра (электронное облако неподеленной пары больше, чем связывающей). Рис. 3
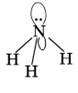

Рис. 3. Строение аммиака
Строение воды
У атома кислорода 6 электронов на внешнем уровне. Поэтому на двух sp3-орбиталях расположены неподеленные пары электронов, а на остальных двух – электронные пары связей О-H. Молекула имеет угловое строение. Рис. 4.
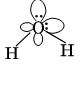
Рис. 4. Строение воды
При таком анализе строения молекул важно не путать геометрию расположения в пространстве электронных пар и геометрию химических связей. Мы видим, что в аммиаке и воде не все электронные пары участвуют в образовании химических связей.
Геометрия молекул или химических связей рассматривает именно расположение атомов в пространстве, не описывая расположение неподеленных электронных пар. Электронные облака гибридных орбиталей стараются как можно дальше оттолкнуться друг от друга. Если облака четыре– то они разойдутся по углам тетраэдра, три – разместятся в плоскости под углом 120°.
Строение молекулы BF3
На внешнем уровне атома бора 3 электрона. При образовании связей бор, как и углерод, переходит в возбужденное состояние. Одна s- и две p-орбитали, на которых есть электроны, гибридизуются, образуя три одинаковых sp2-гибридных орбитали, располагающиеся по углам равностороннего треугольника с атомом бора в центре. Рис. 5
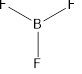
Рис. 5. Строение три фторида бора
Вывод: Геометрия молекул рассматривает расположение атомов в пространстве, не описывая расположение неподеленных электронных пар. Так, строение молекулы воды, состоящей из трех атомов, – не тетраэдрическое, а угловое.
Подведение итога
Вы получили представление о теме «Геометрия молекул. Понятие о теории гибридизации». Был раскрыт универсальный характер процесса гибридизации для органических, сложных неорганических веществ и аллотропных модификаций углерода. Вы узнали о зависимости геометрии молекул от типа гибридизации электронных орбиталей и свойств веществ от геометрии молекул.
