Электронное строение атома углерода
1. Квантовые числа, описывающие электронное состояние атома
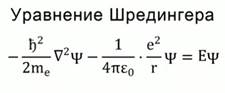
Рис. 1. Уравнение Шредингера
Особенности строения органических соединений связаны с особенностями строения атома углерода. Особенности строения атома углерода объясняет наука квантовая механика. Основные положения квантовой механики сводятся к необходимости решить уравнение Шредингера, описывающее поведение электронов в атоме. Рис. 1. В результате решения получается набор, описываемый 4-мя квантовыми числами, которые позволяют предсказать очень многое в свойствах атома. Квантово-механические расчеты позволяют определить наиболеее устойчивые конфигурации атомов и молекул.
Описание электронного состояния атома
Рис. 2. Атом водорода
Рассмотрим простейший атом – атом водорода. Он состоит из одного электрона и одного протона. Рис. 2. Энергию электрона в атоме водорода можно представить как большую лестницу в многоэтажном здании. Наибольшая энергия присутствует на так называемых лестничных пролетах.
· В квантоой механике – это главное квантовое число.(n). Оно принимает значения 1, 2, 3, 4 и т. д.
· Орбитальное квантовое число можно представить как ступеньки между лестничными пролётами. Оно принимает значения от нуля l = 0, 1, 2,.. до n-1.
Буквенные обозначения орбитального квантового числа : s, p, d, f и т. д.
· Поведение электрона описывает третье число: магнитное квантовое число ml
( ml )= -l,…-2, -1, 0, +1, +2,…+l
· Спиновое квантовое числоms.Оно принимает значения ms=+1/2, -1/2, независимо от главного и орбитального квантовых чисел.
Спин электрона позволяет ему взаимодействовать с другим электроном, несмотря на электрические силы отталкивания, которые имеют очень большие величины. Рис. 3.
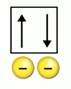
Рис. 3. Электроны с разными ms
2. Принцип Паули

Рис. 4. В. Паули (1900-1958)
Для описания поведения электрона в атоме нужен принцип, устанавливающий взаимосвязь всех квантовых чисел. Этот принцип вывел немецкий теоретик В. Паули. Рис. 4. Он гласит: В одной квантовой системе не может быть двух квантовых объектов с полностью одинаковым набором квантовых чисел. Т.е. в одном атоме не может быть двух одинаковых электронов. Используя квантовые числа и принцип Паули, получаем электронное строение атомов.
Рис. 5. Электронное строение атома углерода
3. Уникальность атома углерода
Рассмотрим строение атома углерода. Углерод оказался уникальным атомом. В чем его уникальность? В нем присутствует некая симметрия. На 4-х орбиталях находится 4 электрона. Он может образовывать целых 4 связи. Это максимальное число связей для элементов второго периода. Рис. 5.
Углерод в своих соединениях проявляет валентность II и IV. Двухвалентный углерод находится в своей основной электронной конфигурации, а IV-валентный находится в возбужденной конфигурации. При переходе в возбужденное состояние, электрон с 2s орбитали занимает вакантное место на 2р орбитали. Рис. 6. При образовании химической связи происходит гибридизация электронных облаков. Углерод может проявлять степени окисления от -4 до +4. К неорганическим соединениям углерода относятся его оксиды, угольная кислота, её соли – карбонаты и гидрокарбонаты и карбиды. В неорганических соединениях углерод проявляет степень окисления +4, +2, и несколько отрицательных степеней окисления в карбидах.
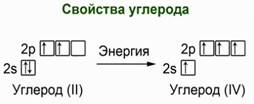
Рис. 6. Два состояния атома углерода
Одной из особенностей атомов углерода есть его особенность образовывать цепочки неограниченной длины. Из-за этого и существует огромное число органических соединений.
4. Четыре первопринципа
Описание мира на основе четырех базовых первопринципов не было открытием тех ученых, которые создавали квантовую механику. С V века до нашей эры известно, что картина мира, как в европейской части земного шара, так и в Древнем Китае описывалась на базе 4-х первопринципов. Это принципы огня, воздуха, земли и воды. В XX веке их заменили 4 квантовых числа.
Подведение итога
Вы изучили тему «Электронное строение атома углерода». Было сформировано понятие об электронных орбиталях и возможных валентных состояниях атома углерода, рассматривался принцип Пауля. Проводилось составление электронно-графических формул атомов химических элементов.
