Решение качественных задач по органической химии
Задачи на объяснение фактов или тенденций
Качественные, т. е. нерасчетные, задачи можно условно разделить на несколько типов.
I. Задачи на объяснение фактов или тенденций.
Задача 1
Условие задачи. Согласно справочным данным, фенол представляет собой бесцветные прозрачные кристаллы.Тем не менее химический реактив фенол, стоящий в банке на полке (Рис. 1), всегда окрашен в розовый цвет. Почему?

Рис. 1. Фенол
Решение.
Вспомним особенности строения фенола (рис. 2).
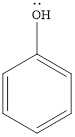
Рис. 2. Строение фенола
Поскольку это бензольное кольцо, к которому присоединен атом заместителя кислорода, содержащего неподеленную электронную пару, то происходит взаимодействие электронов кислорода и бензольного кольца.
В результате происходит сопряжение π – электронов бензольного кольца и электронной пары атома кислорода. Активность всего бензольного кольца существенно возрастает. Получается вещество, гораздо менее устойчивое к окислению по сравнению с исходным бензолом.
Поэтому фенол всегда загрязнен продуктами окисления, имеющими яркую окраску. В результате он имеет характерный розовый цвет.
Задачи на сравнение свойств веществ
II. Задачи на сравнение свойств веществ
Задача 1
Условие задачи. Как изменятся свойства уксусной кислоты, при замене водородов в метильном радикале на атомы хлора: СН3-СООН→ СН2Cl-СООН→ СНCl2-СООН→ СCl3-СООН?
Решение.
При замещении водорода хлором хлор как более электроотрицательный атом стягивает на себя электронную плотность.
Эта электронная плотность смещается от карбоксильной группы и, соответственно, от карбоксильного атома водорода
СН3-СООН< СН2Cl-СООН< СНCl2-СООН<СCl3-СООН
Атом водорода приобретает более положительный заряд. Уксусная кислота с заменой водорода на хлор в своем углеводородном радикале становится более легко диссоциирующей.
У нее становится более высокая константа диссоциации по сравнению с исходной уксусной кислотой.
СН3-СООН< СН2Cl-СООН<СНCl2-СООН< СCl3-СООН
К= 1,8·10-5 1,4·10-3 5,0·10-2 2,0·10-1
Трихлоруксусная кислота СCl3-СООН уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
Задачи на качественный анализ органических соединений
III. Задачи на качественный анализ органических соединений
Задача 1
Условие задачи. Соединение А – легкокипящая жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода .Плотность паров одного из этих соединений В – лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди (II) в вещество С, которое используется для сохранения биологических препаратов.
Приведите возможные формулы веществ А, В, С.
Решение.
То, что могло быть окислено оксидом меди (II), является альдегидом.
R-CH2-OH + CuO ![]() R-CH=O + Cu + H2O
R-CH=O + Cu + H2O
Делаем предположение: вещество С – альдегид. При этом данный альдегид используется для хранения биологических препаратов. Биологические препараты хранят в растворе формалина. Вещество – С – формальдегид (метаналь) Н - CH=O.
Формальдегид получился из метанола. Значит, вещество В – это метанол.
CH3-OH + CuO ![]() НCH=O + Cu + H2O
НCH=O + Cu + H2O
Метанол CH3-OH немного тяжелее воздуха.
М (CH3-OH) = 32 г/моль, М (воздуха) = 29 г/моль.
Поскольку при гидролизе исходного вещества получились два вещества с одинаковым числом атомов углерода
RCOOCH3![]() RCOOH + CH3-OH, то кислота с одним атомом углерода – это НCOOH – муравьиная кислота.
RCOOH + CH3-OH, то кислота с одним атомом углерода – это НCOOH – муравьиная кислота.
Исходное вещество А – с приятным запахом – это НCOOCH3 – метиловый эфир муравьиной кислоты.
Ответ: А – НCOOCH3; В – CH3-OH; С – формальдегид Н - CH=O
[00:06:20 Задачи на различение веществ]
IV. Задачи на различение веществ
Задача 1
Условие задачи. В трех пробирках находятся три водных раствора: муравьиной кислоты НCOOH, соляной кислоты HCl и этанола C2H5-OH. Как, используя минимальное количество реактивов, различить вещества в пробирках?
Решение
1. Во все три пробирки добавляем индикатор, например метилоранж. В растворах кислот, он изменит свой цвет на красный.
В оставшейся пробирке – этанол C2H5-OH.
2. Муравьиная кислота НCOOH является еще и альдегидом. Действуем на обе кислоты щелочным раствором Сu(ОН)2.
2Сu(ОН)2 ↓+ НCOOH![]() Сu2О↓ + СО2 ↑+ 3Н2О
Сu2О↓ + СО2 ↑+ 3Н2О
Сu2О↓ – осадок красного цвета.
3. В пробирке с соляной кислотой HClсиний осадокСu(ОН)2↓ просто растворится.
Сu(ОН)2 ↓+ 2НCl → СuCl2 ↓+ 2Н2O
Подведение итога
Вы познакомились с решением качественных задач по органической химии. На нём вы рассмотрели примеры качественных (нерасчётных) задач, которые условно можно разделить на несколько типов. Например, на объяснения фактов или тенденций, на сравнения свойств веществ, на качественный анализ органических соединений. Научились правильно решать такие задачи из курса органической химии.
