Ковалентная связь в органических соединениях
Свойства связи (полярность, длина, энергия, направленность)
1. Образование ковалентной связи
Химическая связь имеет в основном электростатический характер. Например, молекула водорода образуется из двух атомов, потому что двум электронам энергетически выгодно находиться в поле притяжения двух ядер (протонов). Это состояние в виде молекулы Н2 обладает меньшей энергией по сравнению с двумя отдельными атомами водорода.
Большинство органических веществ содержат ковалентные связи.
Для образования ковалентной связи между двумя атомами каждый атом обычно предоставляет в общее пользование по одному электрону.
В упрощенной модели используется двухэлектронное приближение, т.е. все молекулы строятся на основании суммирования двух электронных связей, характерных для молекулы водорода.
С точки зрения закона взаимодействия электрических зарядов (закон Кулона) электроны не могут сблизиться из-за огромных сил электростатического отталкивания. Но, согласно законам квантовой механики, электроны с противоположно направленными спинами взаимодействуют друг с другом и образуют электронную пару.
Если ковалентную связь обозначать как пару электронов, получим еще один вид записи формулы вещества – электронную формулу или формулу Льюиса
(амер. Дж. Льюис, 1916 г.). Рис. 1.
![]()
Рис. 1. Формулы Льюиса
В органических молекулах имеются не только одинарные связи, но еще двойные и тройные. В формулах Льюиса их обозначают, соответственно, двумя или тремя парами электронов. Рис. 2
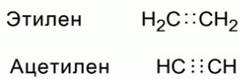
Рис. 2. Обозначение двойной и тройной связей
2. Полярность химической связи
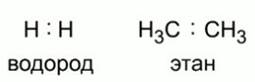
Рис. 3. Ковалентная неполярная связь
Важной характеристикой ковалентной связи является ее полярность. Связь между одинаковыми атомами, например в молекуле водорода или между атомами углерода в молекуле этана неполярная – в ней электроны в равной степени принадлежат обоим атомам. См. Рис. 3.
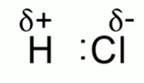
Рис. 4. Ковалентная полярная связь
Если же ковалентная связь образована различными атомами, то электроны в ней смещены к более электроотрицательному атому. Например, в молекуле хлороводорода электроны смещены к атому хлора. На атомах возникают небольшие частичные заряды, которые обозначают d+ и d-. Рис. 4.
Чем больше разница между электроотрицательности атомов, тем более полярная связь.
3. Взаимное влияние атомов в молекуле
Взаимное влияние атомов в молекуле приводит к тому, что может происходить смещение электронов связи, даже если они находятся между одинаковыми атомами.
Например, в 1,1,1-трифторэтане CH3CF3 электроотрицательные атомы фтора «стягивают» на себя электронную плотность с атома углерода. Часто это обозначают стрелочкой вместо валентной черточки.
В результате у атома углерода, связанного с атомами фтора, возникает недостаток электронной плотности, и он перетягивает валентные электроны к себе. Такое смещение электронной плотности по цепи связей называетсяиндуктивным эффектом заместителей. Рис. 5.
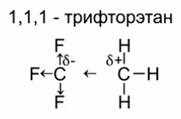
Рис. 5. Смещение электронной плотности в 1,1,1-трифторэтане
Длина и прочность связи
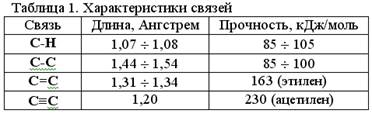
Важными характеристиками ковалентной связи являются ее длина и прочность. Длина большинства ковалентных связей составляет от 1*10-10 м до 2*10-10м или от 1 до 2 в ангстремах (1 А = 1*10-10 м).
Прочность связи – это энергия, которую нужно затратить, чтобы разорвать эту связь. Обычно приводят величины разрыва 1 моль или 6,023*1023 связей. См. табл. 1.
4. Взаимное расположение химических связей
Одно время считалось, что молекулы можно изображать структурными формулами, лежащими в плоскости бумаги, и эти формулы отражают, почти отражают, истинное строение молекулы. Но примерно в середине 19 века выяснилось, что это не так. Впервые к такому выводу пришел, как я уже говорил на предыдущих уроках, тогда еще студент Вант-Гофф. А сделал он это на основании экспериментов выдающегося французского биолога и химика Пастера.
Дело в том, что Пастер занимался изучением солей винной кислоты. И ему, можно сказать, повезло. Кристаллизуя смешанную соль винной кислоты, он под микроскопом обнаружил, что у него получается, в общем-то, набор совершенно одинаковых, весьма симпатичных кристаллов. Но эти кристаллы легко разделить на две группы, которые никак не совместимы друг с другом, а именно: все кристаллы делятся на две части, одна из которых является зеркальным отражением другой.
Так была впервые открыта оптическая, или зеркальная, изомерия. Пастер смог вручную пинцетом под микроскопом разделить эти кристаллы и обнаружил, что все химические свойства практически совпадают. Не совпадает только одно, скорее, физическое свойство, а именно: растворы одного типа кристаллов и ему зеркального другого типа кристаллов по-разному вращали плоскость поляризации света, проходящего через них.
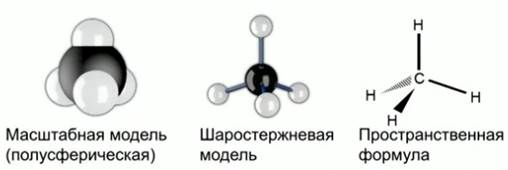
Рис. 6. Модели молекулы метана
Для того чтобы объяснить результаты экспериментов Пастера, Вант-Гофф предположил, что атом углерода находится всегда в неплоском окружении, причем это не плоское окружение не имеет ни центра, ни плоскости симметрии. Тогда атом углерода, соединенный с 4 другими различными фрагментами молекулы, не одинаковыми между собой, должен обладать зеркальной симметрией. Именно тогда Вант-Гофф предположил тетраэдрическое строение атома углерода. Оптическая изомерия следовала из этого предположения. В результате удалось объяснить пространственное строение органических соединений. Рис. 6.
Но ученые столкнулись с еще одной загадкой, которую не удалось разрешить до сих пор. Дело в том, что в природе органические соединения, которые образуются действительно в органической живой материи, как правило, содержат левовращающие, имеется в виду плоскость поляризации проходящего света, аминокислоты и правовращающие сахара. В то время как при любом органическом синтезе обязательно получается смесь таких изомеров.
Причина такой избирательности живой природы не ясна до сих пор. Но это не мешает ученым продолжать синтезировать все новые органические соединения и изучать их свойства.
В нарисованных на плоскости формулах не отражается пространственное расположение атомов относительно друг друга. Однако тетраэдрическое строение атома углерода в молекулах с одинарными связями приводит к существованию оптической изомерии
Подведение итога
Вы получили представление о теме «Ковалентная связь в органических соединениях». Вы вспомнили природу химических связей. Узнали о том, за счет чего образуется ковалентная связь, что является основой этой связи. Рассмотрели принцип построения формул Льюиса. Узнали о характеристиках ковалентной связи (полярности, длине и прочности), что такое индуктивный эффект.
