Валентные возможности атомов химических элементов
Валентные электроны и валентность
Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. Например, в атоме фосфора 5 валентных электронов: ![]() (рис. 1).
(рис. 1).
![]()
![]()
Рис. 1. Электронная формула атома фосфора
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предпоследнего слоев.
Валентность – это способность атома образовывать химические связи. Данное определение и само понятие валентность корректны только по отношению к веществам с ковалентным типом связи. Для ионных соединений это понятие неприменимо, вместо него используют формальное понятие «степень окисления».
Валентность характеризуется числом электронных пар, образующихся при взаимодействии атома с другими атомами. Например, валентность азота в аммиаке NH3 равна трем (Рис. 2).
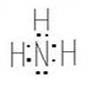
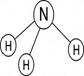
Рис. 2. Электронная и графическая формулы молекулы аммиака
Основное и возбужденное состояния атома
Количество электронных пар, которое может образовать атом с другими атомами, зависит, в первую очередь, от числа его неспаренных электронов. Например, в атоме углерода два неспаренных электрона – на 2р-орбиталях (Рис. 3). По числу неспаренных электронов мы можем сказать, что такой атом углерода может проявлять валентность, равную II.
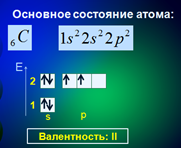
Рис. 3. Электронное строение атома углерода в основном состоянии
Во всех органических веществах и некоторых неорганических соединениях углерод четырехвалентен. Такая валентность возможна только в возбужденном состоянии атома углерода, в которое он переходит при получении дополнительной энергии.
В возбужденном состоянии в атоме углерода распариваются 2s-электроны, один из которых переходит на свободную 2р-орбиталь. Четыре неспаренных электрона могут участвовать в образовании четырех ковалентных связей. Возбужденное состояние атома принято обозначать «звездочкой» (Рис. 4).
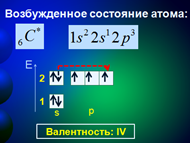
Рис. 4. Электронное строение атома углерода в возбужденном состоянии
Валентные возможности атомов
Может ли азот иметь валентность, равную пяти – по числу его валентных электронов? Рассмотрим валентные возможности атома азота.
В атоме азота два электронных слоя, на которых расположено всего 7 электронов (Рис. 5).
7N![]()
Рис. 5. Электронная схема строения внешнего слоя атома азота
Азот может образовать три общие электронные пары с тремя другими электронами. Пара электронов на 2s-орбитали тоже может участвовать в образовании связи, но по другому механизму – донорно-акцепторному, образуя четвертую связь.
Распаривание 2s-электронов в атоме азота невозможно, т. к. на втором электронном слое нет d-подуровня. Поэтому высшая валентность азота равна IV.
Подведение итога
Вы научились определять валентные возможности атомов химических элементов. В ходе изучения материала вы узнали, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
