Геометрия молекул с кратными связями
1. Образование σ-связи
Электронам при образовании химической связи выгодно располагаться так, чтобы максимум электронной плотности был между центрами связанных атомов.
Для более детального описания в органической химии используется модель гибридизации в двух электронном приближении – все связи описываются как образованные независимыми электронными парами.
Если максимум электронной плотности лежит на линии, соединяющей центры связанных атомов, то говорят, что образуется σ-связь.
Образование σ-связи происходит при перекрывании, например, двух s-электронных облаков, s- и p-электронных облаков, двух p-электронных облаков. Рис. 1.
|
|
|
|
Рис. 1. Перекрывание электронных облаков
2. Образование π-связи
Гибридные орбитали образуют σ-связи. Если связь образована в сумме двумя или тремя парами электронов, то σ-связь образует только одна пара.
Вторая и третья электронные пары не могут находиться в той же области пространства. Их максимум электронной плотности располагается вне центров связанных атомов. Такой тип перекрывания называют π-связью. Рис. 2.
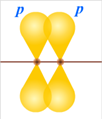
Рис. 2. Образование π связи
Образование π-связи у атомов элементов второго периода происходит только при перекрывании двух p-электронных облаков.
σ-связь более прочна, чем π-связь.
Если атомы в молекуле связаны только простыми (одинарными) связями, то это – σ-связи. Если же между атомами существует двойная связь, то одна пара электронов образует σ-, а вторая – π-связь. Три пары электронов тройной связи образуют одну σ- и две π-связи.
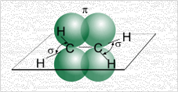
Рис. 3. Образование связей в молекуле этилена
3. Геометрия молекулы этилена
В молекуле этилена каждый атом углерода образует по три σ-связи с двумя атомами водорода и другим атомом углерода. А p-электрон углерода образует π-связь с p-электроном другого такого же атома углерода. Максимум электронной плотности π-связи в молекуле этилена расположен вне оси, связывающей два атома. Рис. 3.
В органической химии принято использовать для описания связей модель гибридизации. В молекуле этилена C2H4 одна p-орбиталь остается негибридизованной для образования p-связи. На гибридизацию идут одна s- и две p-орбитали, при этом образуются три sp2-гибридных орбитали, которые, располагаясь как можно дальше друг от друга, находятся в плоскости под углом 120о. Все атомы в молекуле этилена расположены в одной плоскости. Молекула плоская. Рис. 4. Атомы углерода в этилене находятся в состоянии sp2-гибридизации.
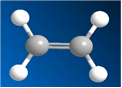
Рис. 4. Шаростержневая модель этилена
4. Геометрия молекулы ацетилена
В молекуле ацетилена C2H2 каждый атом углерода образует по две σ- и по две π-связи. Рис. 5.
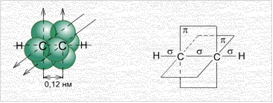
Рис. 5. Образование связей в молекуле ацетилена
На образование π-связей идут две негибридизованные p-орбитали, а на гибридизацию остаются тоже две орбитали: одна s- и одна p-орбиталь.
В этом случае атомы углерода имеют sp-гибридизацию. Две гибридизованные орбитали располагаются, максимально не мешая друг другу, на одной прямой. Атомы в молекуле ацетилена расположены на одной прямой. Молекула линейная. Рис. 6. Атомы углерода находятся в состоянии sp-гибридизации.
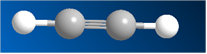
Рис. 6. Шаростержневая модель молекулы ацетилена
5. Алгоритм образования типа гибридизации
1. Определить число σ-связей, которые образует данный атом и число неподеленных электронных пар на его внешнем уровне. Число σ-связей равно числу атомов, присоединенных к данному.
2. Сложить эти два числа.
3. Если сумма равна 4 – гибридизация sp3, если 3 – sp2, если 2 – sp.
6. Тип гибридизации в молекуле оксидов углерода
Вы получили представление о теме «Геометрия молекул с кратными связями». Были рассмотрены вопросы образования химических связей с участием двух или трех пар электронов; особенности расположения этих электронов в пространстве, расположения атомов в молекуле, образованной такими связями. Вы узнали, что такое s-связь и π-связь. Были систематизированы знания о зависимости пространственной конфигурации молекул от типа гибридизации атомных орбиталей. Было показано, как определять геометрию различных частиц.
