Химические свойства аминов. Основность аминов (Загорский В.В.)
Горение аминов
Наиболее общие свойства всех органических соединений – способность их гореть. Сам аммиак горит и, в общем, легко, но поджечь его не всегда просто. В отличие от него амины загораются легко и горят чаще всего бесцветным или малоокрашенным пламенем. При этом азот аминов традиционно окисляется до молекулярного азота, поскольку оксиды азота малоустойчивы.
Амины загораются на воздухе легче, чем аммиак.
4NH3 + 3O2 = 2N2 + 6H2O;
4С2H5NH2 + 15O2 = 8CO2 + 14H2O + 2N2.
Основность аминов
Основные свойства
Первичные, вторичные и третичные амины обязательно содержат неподеленную электронную пару, как и полагается трехвалентному азоту. То есть амины в растворе проявляют основные свойства, или их растворы являются основаниями. Именно поэтому амины в водном растворе окрашивают лакмус в синий цвет, а фенолфталеин в малиновый. Рис. 1, 2.

Рис. 1. Окраска лакмуса с аминами

Рис. 2. Фенолфталеин с аминами
Благодаря этой электронной паре может образовываться донорно-акцепторная связь с ионом водорода:
С2Н5NH2 + H+ = C2H5NH3+.
Таким образом, подобно аммиаку, амины проявляют свойства оснований:
NH3 + H2O ![]() NH4OH;
NH4OH;
С2Н5NH2 + H2O ![]() C2H5NH3OH.
C2H5NH3OH.
С кислотами аммиак образует соли аммония, а амины – алкиламмония:
NH3 + HBr = NH4Br (бромид аммония)
С2Н5NH2 + HBr = C2H5NH3Br (бромид этиламмония)
Точно так же, как с кислотами аммиак образует соли аммония, амины образуют соответствующие соли. Эти соли могут быть образованы, как и в случае аммиака, не только при реакции водных растворов, но и в газовой фазе, если амины достаточно летучи.
То есть, если поставить рядом сосуды с концентрированной соляной кислотой или даже с органической летучей, например уксусной, и сосуд с летучим амином, то скоро между ними в пространстве появится нечто напоминающее дым без огня, т. е. будут образовываться кристаллики, соответствующие соли алкиламина. Рис. 3.

Рис. 3. Образование солей алкиламмония
Щелочи вытесняют амины, являющиеся, как и аммиак, слабыми основаниями, из солей алкиламмония:
NH4Cl + KOH = NH3 + KCl + H2O;
CH3NH3Cl + KOH = CH3NH2 + KCl + H2O.
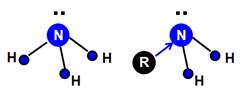
Основные свойства аминов выше, чем у аммиака. Почему? Образование донорно-акцепторной связи с ионом водорода происходит тем легче, чем выше электронная плотность на атоме азота. Углеводородные радикалы содержат много электронов и охотно «делятся» ими с атомом азота (рис. 4).
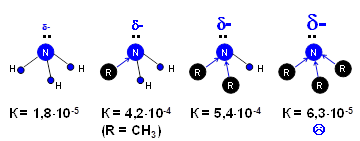
Рис. 4. Донорно-акцепторная связь с ионом водорода
Однако основные свойства третичных аминов меньше, чем вторичных (сравните константы основности). Почему? В третичном амине атом азота со всех сторон окружен углеводородными радикалами, и его способность вступать в реакции затруднена.
Нуклеофильное замещение
Амины, подобно аммиаку, способны реагировать с галогеналканами, замещая атом галогена:
СН3Br + NH3 = CH3NH2 + HBr;
СH3NH2 + CH3Br = (CH3)2NH + HBr;
(CH3)2NH + CH3Br = (CH3)3N + HBr.
Замещать галоген могут и третичные амины, так что реакция может пойти и дальше. Образуется четвертичная аммониевая соль – бромид тетраметиламмония (CH3)4NBr:
(CH3)3N + CH3Br = (CH3)4N+ + Br-.
Подведение итога
Была рассмотрена тема «Аминосоединения. Классификация, изомерия, названия и физические свойства». Вы повторили генезис кислородсодержащих органических соединений и вспомнили о некоторых общих свойствах аммиака и воды. Затем рассмотрели, как получить аминосоединения. Изучили их классификацию, изомерию, названия и присущие им физические свойства.
