Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона
1. Характеристика разных форм таблицы
В начале XX века было открыто строение атома и стало ясно, что свойства химических элементов находятся в периодической зависимости не от атомных масс, а от заряда ядра атома, т. е. числа протонов в ядре.

Рис. 1. "Длинная" форма таблицы
Дальнейшее развитие Периодической системы заключалось в том, что ученые заполняли пустые клетки в таблице Менделеева: открыли семейство благородных газов. Открывались естественно и искусственно полученные радиоактивные элементы. В 2010 году был открыт последний 117 химический элемент, 7 периода Периодической системы.
Таким образом, перед учеными встал вопрос о нижней границе Периодической системы, который остается открытым до сих пор.
Чаще всего можно увидеть три формы выражения Периодической системы: короткая или короткопериодная, длинная или длиннопериодная или сверхдлинная.
В короткой форме таблица изображена на Рис. 2.
1-3 периоды занимают по 1 строке, 4-ый и последующие периоды занимают по 2 строчки. Символы элементов главных и побочных подгрупп выравниваются относительно разных краев клеток. Лантаноиды и актиноиды вынесены из общей таблицы.
В длинном варианте лантаноиды и актиноиды вынесены из общей таблицы, соответственно, так же как и в короткой, делая её более компактной. Нет главных и побочных подгрупп. Каждый период занимает ровно одну строчку. Рис. 1.
2. Короткая форма Периодической системы
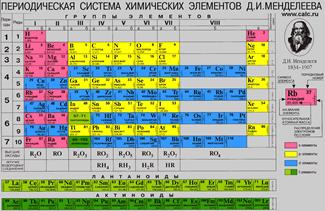
Рис. 2. "Короткая форма"

Рис. 3. Клеточка таблицы
Каждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента. Рис. 3.
Период начинается щелочным металлом и заканчивается инертным газом.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
1-ый, 2-ой , 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
4-7 периоды называются большими. 4-ый и 5-ый периоды включают в себя 18 элементов. 6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды. Они обладают одинаковыми свойствами.
Совокупность переходных металлов в каждом периоде называется вставной декадой, потому что этих металлов в каждом периоде 10.

Рис. 4. Вторая группа
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа. Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа. Например, рассмотрим II группу периодической системы. Рис. 4.
Бериллий Be – элемент 2-го периода.
Он начинает столбик элементов главной подгруппы. В её состав входят: Be. Mg, Ca, Sr, Ba, Ra.
Цинк Zn начинает побочную подгруппу, так как он входит в состав 4-го периода. В побочную подгруппу входит Zn, Cd, Hg.
3. Характеристика химического элемента по положению в таблице

Рис. 5. Химический элемент бром
Рассмотрим элемент Br. Рис. 5. Его порядковый номер – 35, относительная атомная масса – 80. Находится в 4-ом периоде, в 7-ой главной подгруппе.

Рис. 6. Химический элемент платина
Рассмотрим элемент платину. Рис. 6.
Символ – Pt, порядковый номер – 78, относительная атомная масса – 195. Находится в 6-м периоде, в 8-й побочной подгруппе.
В состав каждой группы входит элементы с одинаковым числом валентных электронов. Следовательно, они будут обладать схожими химическими свойствами.
4. Названия некоторых групп элементов
Это отражается в названии некоторых групп элементов.
- Например, элементы главной подгруппы 1-ой группы – Li, Na, K, Rb, Cs, Fr – называются щелочные металлы.
- Элементы главной подгруппы 2-ой группы – Ca, Sr, Ba, Ra – называются щелочноземельные металлы.
- Халькогены O, S, Se, Te, Po – элементы 6-й группы главной подгруппы.
- Галогены: F, Cl, Br, J, At – элементы 7-й группы главной подгруппы.
- 8-ю главную подгруппу называют подгруппой инертных или благородных газов. Это He, Ne, Ar, Kr, Xe, Ra.
Химические свойства в периодах меняются с металлических через амфотерные на неметаллические. Таким образом, зная химические свойства элемента, можно предположить, где конкретно он находится в Периодической системе. И наоборот, если знать положение элемента в Периодической системе, можно предположить его химические свойства.
5. Значение Периодического закона Д.И. Менделеева
С момента открытия Периодического закона и Периодической системы химических элементов Д.И. Менделеева, химия перестала быть описательной наукой. Теперь при помощи его таблицы можно предсказывать свойства любого химического элемента. Дальнейшее развитие физики и химии полностью подтвердило правоту Д.И. Менделеева, так были открыты семейства инертных газов. Для радиоактивных элементов были сначала описаны свойства, а затем они были получены. Периодический закон и Периодическая система химических элементов Д.И. Менделеева носят фундаментальный характер, являются основным законом природы.
Подведение итога
Вы изучили тему «Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона». Вы узнали о значении Периодической таблицы Менделеева, ее функциях и возможностях.
