Становление в науке представлений о строении атома
1. Учение Демокрита

Атом – это мельчайшая химически неделимая частица вещества.
Впервые понятие атом было сформулировано в V- IV веках до нашей эры древнегреческим ученым Демокритом. Он предполагал, что свойства того или иного вещества определяется формой, массой и другими характеристиками образующих его атомов. Так по представлению Демокрита у огня атомы остры, поэтому он и обжигается. Твердые тела состоят из шероховатых атомов, которые позволяют веществу цепляться друг за друга. Атомы воды имеют гладкую структуру, поэтому она течет. Даже душа человека, по мнению Демокрита, состоит из атомов.

Рис. 1. Empire State Building
Выдающийся американский физик Ричард Фейнман однажды сказал, что если бы всю историю науке надо было бы свести к одной фразе, то тогда бы она звучала так: « Всё вокруг состоит из атомов».
Атомы – это мельчайшие неделимые частички вещества. Они настолько малы, что представить их размер очень сложно. Так, например полмиллиона атомов , стоящих плечом друг к другу могли бы спрятаться за человеческим волосом. Еще пример: если представить, что радиус атома равен толщине листа бумаги, тогда миллиметр на линейке – это будет высота Empire State Building. Рис.1.


2. Представление о строении атома Джона Дальтона
Научно понимание, что атомы малы и неделимы, впервые пришло в голову английскому ученому Джону Дальтону. Он в 1808 году издает свой труд под названием : « история химической философии». Этот труд был написан им на 90 страницах. И только на 5 из них Дальтон говорит о том, что все вещества состоят из мельчайших частиц неделимых и очень маленьких. Но известно, что понятие «атом» было введено еще древними греками. В чем же заслуга тогда Дальтона? Он был первым, кто описал свойства атомов, их размеры. Он сказал, что самым легким атомом является атом водорода и приписал ему атомную массу равную единице.
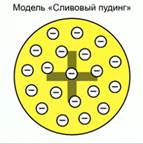
Рис. 2. Модель ученые назвали «Сливовый пудинг»
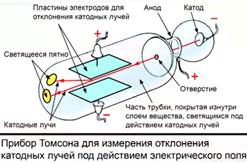
Рис. 3. Прибор Томсона для измерения отклонения катодных лучей в электрическом поле
3. Представление о строении атома Джозефа Томсона
В 1897 году английский физик Джозеф Томсон сконструировал прибор, с помощью которого можно было измерять отклонение катодных лучей в электрическом поле. Рис.3. Прибор состоял из стеклянной трубки, двух электродов – катода и анода. Противоположная часть стеклянной трубки была покрыта флуоресцирующим веществом, т.е. она светилась под действием катодных лучей. Этот эксперимент помог изучить частицы, из которых состоят катодные лучи. Томсон доказал, что катодные лучи состоят из мельчайших отрицательно заряженных частиц, которые не имеют практически массы. Эти частички он назвал электронами. Чуть позже при помощи такого же прибора были открыты другие частицы. Их назвали протонами. Они имели массу в 1823 раза большую, чем электроны. То же самое значение заряда, только со знаком плюс. Таким образом, Томсон обнаружил 2 частицы, входящих в состав атома и уже мог создавать какие либо модели атома. Он был первым, кто предположил, что атом состоит из элементарных частиц: протонов и электронов.
Томсон сказал, что атом представляет собой положительно заряженную сферу с вкраплением в нее отрицательно заряженных электронов. Его модель ученые назвали «Сливовый пудинг», хотя она похожа и на булочку с изюмом, где изюм – это электроны или на арбуз с семечками - электронами. Рис.2.
Первым неопровержимые доказательства существования атома дал Альберт Эйнштейн в своей работе в 1905 года о броуновском движении. Но эта проблема Эйнштейна привлекала мало, так как он был занят разработкой теории относительности.

4. Представление о строении атома Эрнеста Резерфорда
Главным героем атомного века стал Эрнест Резерфорд. В 1910 году Эрнест Резерфорд изучал рассеивание α- частиц, проходящих через тонкую золотую фольгу, падающих на свинцовый экран. α- частицы – это ядра атома гелия. Они обычно чуть отклонялись от первоначального направления. Некоторые из них резко меняли направление с его движением, будто сталкивались с какой-то преградой. Некоторые α- частицы, к удивлению Резерфорда летели прямо в противоположном направлении, словно по его словам, он выстрелил 15-дюймовым снарядом в лист бумаги и снаряд отскочил ему на колени. Расчеты показали, что такое может произойти только, если в центре атома есть ядро, в котором сосредоточен весь положительный заряд атома и вся его масса.
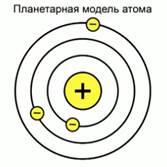
Рис. 4. Планетарная модель атома
В 1911 году Эрнест Резерфорд создал свою планетарную модель строения атома. Рис.4.
Эта модель предполагает следующее строение атома.
В центре атома находится ничтожное ядро, в состав которого входит положительно заряженные частицы. Вся масса атома также сосредоточена в ядре. Вокруг этого ядра по орбитам, похожим на планетарные, как планеты вокруг солнца вращаются электроны. Рис..4.. Планетарная модель атома Эрнеста Резерфорда была очень наглядной, но сразу же выявились её недостатки.
Электрон вращается вокруг ядра за счет центростремительной силы, т.е. он движется с ускорением. А так как электрон является еще и заряженной частицей, то со временем согласно электромагнитной теории, он должен излучать энергию. Следовательно, электрон должен упасть на ядро, а атом перестать существовать. Но такое ведь не происходит.
· Еще можно опровергнуть теорию Эрнеста Резерфорда еще и тем, что атом гелия, например, имеет массу, равную 4, что в 4 раза больше массы одного протона. А известно, что в атоме всего 2 протона. Следовательно, модель атома Эрнеста Резерфорда была в чем-то ошибочной.

В 1913 году при изучении рентгеновских лучей Генри Мозли предположил, что ядро, кроме протонов содержит нейтральные частицы с массой равной массе протона. Эта догадка была подтверждена только в 1932 году Джеймсом Чедвиком.
Сейчас принято называть совокупность протонов и нейтронов в ядре атома - нуклонами и их массу – массовым числом. Протоны называются порядковым номером элемента или атомным номером.
5. Теория строения атома Нильса Бора
В 1913 году датский физик Нильс Бор предложил свою теорию строения атома. Нильс Бор полностью не отрицает модель строения атома Эрнеста Резерфорда, но вносит в неё некоторые уточнения. Так по его мнению электроны вокруг ядра вращаются не произвольным , а по строго определенным орбитам при этом не поглощают и не выделяют энергию. Следовательно, Нильс Бор утверждает, что электроны в атоме не подчиняются законам классической физики.
В последующие годы постулаты Нильса Бора были переработаны, и появилось новое направление в квантовой химии или физики, которое объясняло строение атома.
Подведение итога
Вы познакомились со становлением в науке представлений о строении атома. Вы узнали историю открытия строения атома, повторили, как он устроен. Рассмотрели опыты, которые ставились учеными в прошлом с целью получить все эти знания, и таким образом, помогали им получить представление о строении атома.
