Попытки классификации химических элементов. Открытие периодического закона
1. Триады Дёберейнера
Попытки классификации химических элементов начались задолго до открытия Д.И.Менделеевым периодического закона. Естествоиспытатели в начале XIX сталкивались с большими трудностями в этом направлении, потому что химических элементов было известно всего 63, а атомные массы были определены для них неточно.
Триады Дёберейнера.

В 1829 году немецкий химик И.В.Дёберейнер заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы. Он назвал их триадами.
Сущность данной классификации заключается в следующем: в каждой триаде есть средний элемент, масса атома которого будет равна средней арифметической массе двух крайних элементов.
Например, рассмотрим первую триаду: Li, Na, K.
Их атомные массы соответственно равны 7, 23, 39.
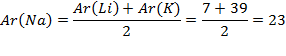
Система классификации И.В.Дёберейнера оказалась несовершенной. Некоторые триады не содержали тех элементов, которые были бы похожи с ними по химическим свойствам.
Так, например, триада, содержащая S, Se, Te , не содержала кислорода O.
Ошибка И.В.Дёберейнера заключалась в том, что он ограничил себя поиском тройственных союзов, т.е. триад.
Но И.В.Дёберейнер был первым из естествоиспытателей, который связал свойства химических элементов с их атомными массами. Все дальнейшие попытки классификации химических элементов основывались на связи масс атомов с их химическими свойствами.
2. Спираль Шанкуртуа

В середине XIX века появилось много работ ученых, которые пытались классифицировать химические элементы. Французский геолог и химик А.Э. Шанкуртуа в 1862 году предложил свою классификацию химических элементов.

Рис. 1. Спираль Шанкуртуа
Он расположил все известные к тому времени химические элементы в порядке возрастания их атомных масс, а полученный ряд нанес на поверхность цилиндра, по линии исходя из его основания под углом 45![]() к плоскости основания, так называемая земная спираль. Рис.1. После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан.
к плоскости основания, так называемая земная спираль. Рис.1. После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан.
3. Октавы Ньюлендса

В 1865 году 18 августа английский ученый Дж.А.Ньюлендс расположил химические элементы в порядке возрастания их атомных масс. В результате он заметил, что каждый восьмой элемент напоминает по свойствам первый элемент. Найденную закономерность, он назвал законом октав по аналогии с семью интервалами музыкальной гаммы.Рис.2.Закон октав он сформулировал следующим образом:
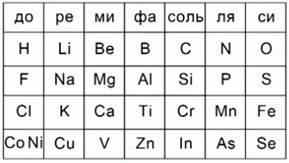
Рис. 2. Октавы Ньюлендса
«Номера аналогичных элементов, как правило, отличаются или на целое число семь или на кратное семи; другими словами члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
Он расположил элементы по семь в группы. Таким образом, он заметил, что вертикальные ряды, полученные после такого расположения, включают в себя элементы, схожие по своим химическим свойствам. Дж.А. Ньюлендс был первым, кто соотнес атомные массы химических элементов и их химические свойства и присвоил каждому элементу порядковый номер. Но все же в его таблице не было свободных мест. Он ограничил себя семью клетками в каждом периоде ,и некоторые клетки ему пришлось поместить по несколько элементов. Поэтому научный мир отнесся скептически к его открытию.
В 1864 году английский химик У. Одлинг опубликовал таблицу, в которой элементы были размещены, согласно их атомным весам и сходствам химических свойств. Но он не дал никаких комментариев к своей работе, и она не была замечена.

4. Таблица химических элементов Мейера
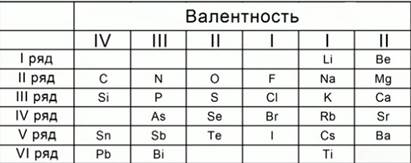
Рис. 3. Таблица химических элементов Мейера
В 1870 году появилась первая таблица немецкого химика Ю.Л. Мейера под названием « Природа элемента, как функция их атомного веса». В неё были включены 28 элементов, размещенные в 6 столбцов, согласно их валентности. Ю.Л. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерные изменения атомной массы в рядах сходных элементов. Рис. 3.Сходные элементы располагаются в вертикальных рядах таблицы. Некоторые ячейки Ю.Л. Мейер оставил незаполненными.

5. Открытие периодического закона Д.И.Менделеевым
В марте 1869 года русский химик Д. И. Менделеев представил русскому химическому обществу сообщение об открытии им периодического закона химических элементов. В том же году вышло первое издание Менделеевского учебника «Основы химии», в котором была приведена его периодическая таблица.
В конце 1870 года Д. И. Менделеев делает доклад русскому химическому обществу под названием «Естественные системы химических элементов и применение её к указанию свойств еще неизвестных элементов». В этом докладе Д. И. Менделеев предсказывает существование трех еще неизвестных элементов: экасилиций, экабор и экаалюминий. Он утверждает, что свойства химических элементов, стоящих в одной группе, будут нечто средним между свойствами элементов, стоящих сверху и снизу данного элемента. Если рассматривать этот элемент в периоде, то он будет обладать средними свойствами элементов, стоящими слева и справа от него.

Рис. 4. Таблица химических элементов Менделеева
В 1871 году в итоговой статье « Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса».
Тогда же Д. И. Менделеев придал своей таблице вид, ставшим классическим, так называемый короткий вариант. Рис.4.
Открытие новых химических элементов
В 1875 году П.Л. Буабодран открыл галлий. В 1879 году Л.Ф. Нильсон открыл скандий, а в 1886 году К.Винклер откывает германий. Это соответственно были экабор , экаалюминий, экасилиций, предсказанные Д. И. Менделеевым.
С этого момента периодический закон и периодическая система Д. И. Менделеева становится общепризнанной всем мировым химическим сообществом. Особая заслуга Д. И. Менделеева заключается в том, что он не только расположил химические элементы в определенной последовательности, но и дал описательную характеристику своей периодической системы. При помощи её можно было предсказывать химические свойства различных химических элементов.
По этому поводу Д. И. Менделеев писал: « Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и неожидаемых, и оправдание тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны вывел из него такие логические следствия, которые могли показать - верен ли он или нет. Без такого способа испытания не может утвердиться ни один закон природы».
Д. И. Менделеев взял на себя смелость оставить пустые клетки в своей таблице и исправить некоторые значения атомных масс химических элементов, предсказать свойства еще неоткрытых целых групп соединений. Таким образом, Д. И. Менделеев является первооткрывателем одного из главных законов природы.
Подведение итога урока
На уроке по теме «Попытки классификации химических элементов. Открытие периодического закона» вы познакомились с подробной исторической справкой о попытках классификации химических элементов учеными-химиками. Узнали о структуре периодического закона химических элементов Д.И. Менделеева, и огромном значении этого закона для химической науки.
