Алкины. Химические свойства и применение
1. Реакции гидрирования и галогенирования
Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.
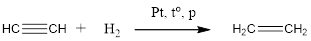
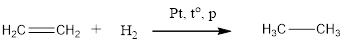
Электрофильное присоединение
Алкины менее активны в электрофильном присоединении, чем алкены. Почему? Потому что тройная связь короче и прочнее, чем двойная. Поэтому в некоторых случаях для осуществления реакции необходимы специальные условия (например, присутствие солей ртути в качестве катализатора).
Реакции присоединения к алкинам могут проходить в два этапа: на первом образуется вещество с двойной связью.
2. Качественная реакция на алкины
1. Галогенирование.
Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.
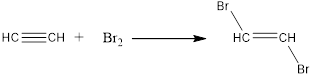
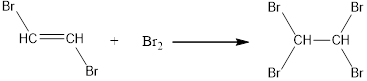
2. Гидрогалогенирование.
Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для синтеза распространенного материала поливинилхлорида (ПВХ):

3. Реакция Кучерова
3. Гидратация (реакция Кучерова)
Реакция проходит в кислой среде в присутствии солей ртути. Образующийся на первой стадии фенол перегруппировывается в карбонильное соединение.
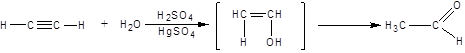
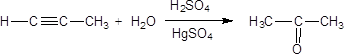
4. Получение ацетилена в лаборатории
Кислотные свойства алкинов
Алкины, у которых при тройной связи есть атом водорода, проявляют свойства очень слабых кислот. Они реагируют, например, с водно-аммиачными растворами солей Cu(I) и Ag(I). Атом водорода замещается на атом металла, выпадает осадок соли, которая называется ацетиленидом.
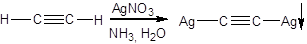
Ацетиленид меди – темно-красный, а ацетиленид серебра – желтый или белый. Это можно использовать при определении алкинов с концевой тройной связью.
Окисление алкинов
1. Обесцвечивание подкисленного раствора перманганата калия – качественная реакция на соединения с кратной связью. Рис. 1.
5HCºCR + 8KMnO4 + 24HCl ®5CO2 + 5RCOOH + 8MnCl2 + 8KCl + 12H2O.
2. На воздухе алкины горят коптящим пламенем:
2С2Н2 + 5О2 = 4СО2 + 2Н2О.

Рис. 1. Обесцвечивание КМnO4
Применение алкинов
Благодаря яркому пламени в XIX веке широко распространились ацетиленовые фонари.
При горении смеси ацетилена с кислородом температура пламени достигает 2800–3000оС – можно плавить многие металлы. На этом свойстве основана ацетиленовая сварка. Рис. 2, 3.

Рис. 2. Ацетиленовая горелка

Рис. 3. Сварка и резка металлов
Кроме того, ацетилен используют в промышленном органическом синтезе для получения винилхлорида, акрилонитрила, винилацетилена – исходных веществ при производстве распространенных полимеров.
Подведение итога
Вы изучили тему «Алкины. Химические свойства и применение». Вы смогли узнать, что представляют собой алкины и какими химическими свойствами характеризуется этот класс соединений. Вы узнали о том, как свойства алкинов влияют на их практическое применение.
