Расчёты массы вступившего в реакцию металла по объёму выделившегося водорода
1. Задача №1
Металлы, стоящие в ряду напряжений левее водорода, способны реагировать с растворами кислот с выделением водорода. Такие реакции являются реакциями замещения. Рассмотрим решение двух задач.
ЗАДАЧА 1. Вычислите массу цинка, вступившего в реакцию с избытком раствора серной кислоты, если выделилось 67,2 л водорода (при н.у.).
Решение: Запишем уравнение реакции и подпишем над формулами веществ, что дано и требуется определить по условию задачи:
х г 67,2 л
Zn + H2SO4 = ZnSO4 + H2
Рассчитаем количество вещества водорода:
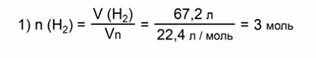
Составим пропорцию:
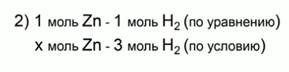
Составим и решим уравнение по пропорции:
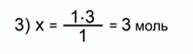
n(Zn) = 3 моль
Найдем массу цинка:
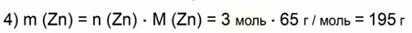
Ответ: 195 г Zn.
2. Задача №2
ЗАДАЧА 2. Вычислите массу алюминия, которую нужно растворить в соляной кислоте, чтобы получить водород объемом 2,24 л (н.у.).
Запишем уравнение реакции, указав данные по условию задачи:
х г 2,24 л
2Al + 6HCl = 2AlCl3 + 3H2
Рассчитаем количество вещества водорода:
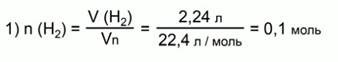
Составим пропорцию:
2 моль Al – 3 моль водорода (по уравнению)
х моль Al – 0,1 моль водорода (по условию задачи)
Составим и решим уравнение по пропорции:
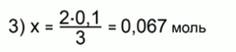
Найдем массу алюминия:
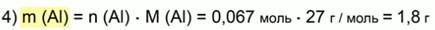
Ответ: 1,8 г Al.
