Общие свойства металлов. Металлическая связь
1. Взаимодействие с кислородом
Для металлов характерны общие физические свойства: они обладают особенным металлическим блеском, высокой тепло- и электропроводностью, пластичностью.
Для металлов также характерны некоторые общие химические свойства. Важно запомнить, что в химических реакциях металлы выступают в качестве восстановителей: отдают электроны и повышают свою степень окисления. Рассмотрим некоторые реакции, в которых участвуют металлы.
ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
Магний горит в кислороде, при этом образуется оксид магния:
0 0 +2 -2
2Mg + O2 = 2MgO

Рис. 1. Горение магния в кислороде
Атомы магния отдают свои внешние электроны атомам кислорода: два атома магния отдают по два электрона двум атомам кислорода. При этом магний выступает в роли восстановителя, а кислород – в роли окислителя.
2. Взаимодействие с галогенами
Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.

Рис. 2. Горение калия в хлоре
Калий сгорает в хлоре образованием хлорида калия:
0 0 +1 -1
2К + Cl2 = 2KCl
Два атома калия отдают молекуле хлора по одному электрону. Калий, повышая степень окисления, играет роль восстановителя, а хлор, понижая степень окисления,- роль окислителя
3. Взаимодействие с серой
Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2. Например, железо при нагревании реагирует с серой с образованием сульфида железа (II):
0 0 +2 -2
Fe + S = FeS

Рис. 3. Взаимодействие железа с серой
Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях.
4. Взаимодействие с водой
С водой без нагревания реагируют только активные металлы, например, щелочные и щелочноземельные. В ходе этих реакций образуется щелочь и выделяется газообразный водород. Например, кальций реагирует с водой с образованием гидроксида кальция и водорода, при этом выделяется большое количество теплоты:
Ca + 2H2O = Ca(OH)2 + H2
Менее активные металлы, например, железо и цинк, реагируют с водой только при нагревании с образованием оксида металла и водорода. Например:
0 +1 -2 +2 -2 0
Zn + H2O = ZnO + H2
В этих реакциях окислителем является атом водорода, входящий в состав воды.
Металлы, стоящие в ряду напряжении правее водорода, с водой не реагируют.
5. Взаимодействие с кислотами
Вы уже знаете, что с кислотами реагируют металлы, стоящие в ряду напряжений левее водорода. В этих реакциях металлы отдают электроны и выступают в качестве восстановителя. Окислителем являются катионы водорода, образующиеся в растворах кислот. Например, цинк реагирует с соляной кислотой:
0 +1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2
Иначе протекают реакции металлов с азотной и концентрированной серной кислотами. В этих реакциях водород практически не выделяется. Мы погорим о таких взаимодействиях на следующих уроках.
6. Взаимодействие с солями
Металл может реагировать с раствором соли, если он активнее, чем металл, входящий в состав соли. Например, железо замещает медь из сульфата меди (II):
0 +2 +2 0
Fe + CuSO4 = FeSO4 + Cu
Железо – восстановитель, катионы меди – окислитель.
7. Внутреннее строение металлов
Попробуем объяснить, почему металлы обладают общими физическими и химическими свойствами. Для этого рассмотрим модель внутреннего строения металла.
Атомы металлов имеют относительно большие радиусы и малое число внешних электронов. Эти электроны слабо притягиваются к ядру, поэтому в химических реакциях металлы выступают в роли восстановителей, отдавая электроны с внешнего энергетического уровня.
В узлах кристаллической решетки металлов находятся не только нейтральные атомы, но и катионы металла, т.к. внешние электроны свободно перемещаются по кристаллической решетке. При этом атомы, отдавая электроны, становятся катионами, а катионы, принимая электроны, превращаются в электронейтральные атомы.
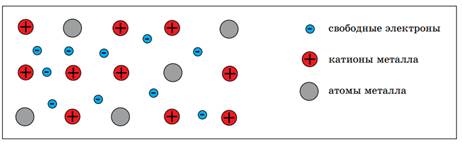
Рис. 4. Модель внутреннего строения металла
Химическую связь, которая образуется в результате притяжения катионов металла к свободно перемещающимся электронам, называют металлической.
Электро– и теплопроводность металлов объясняются наличием свободных электронов, которые могут быть носителями электрического тока и переносчиками теплоты. Пластичность металла объясняется тем, что при механическом воздействии не рвется химическая связь, т.к. химическая связь устанавливается не между конкретными атомами и катионами, а между всеми катионами металла со всеми свободными электронами в кристалле металла.
