Описание элемента по положению в Периодической системе
1. Строение атома элемента
Для того чтобы определить состав ядра и распределение электронов по слоям в атоме химического элемента, нужно знать порядковый номер элемента, номер периода, номер группы и подгруппу в Периодической системе.
Рассмотрим конкретный пример. Определим строение атома калия. Порядковый номер калия равен 19. Порядковый номер определяет число протонов в ядре и общее число электронов в атоме. Число нейтронов в конкретном атоме можно определить по разнице между массовым числом и числом протонов. Для изотопа калия с массовым числом 39 число протонов равно 19, число нейтронов равно 39-19=20, число электронов – 19.
По номеру периода можно определить число электронных слоев в атоме. Калий – элемент 4 периода, значит, все его 19 электронов расположены на 4-х электронных слоях. При этом нужно помнить, что на 1-м слое может максимально находиться не более 2-х электронов, на втором – не более 8. Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (Рис. 1).
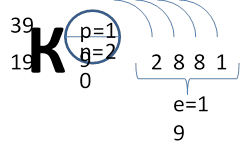
Рис. 1. Схема строения атома калия
Номер группы определяет не только число внешних электронов, но высшую валентность элемента. Численное значение низшей валентности для элементов V-VII групп равно 8 - номер группы. Итак, высшая и единственная валентность калия равна I.
2. Свойства простого вещества, образованного элементом
По положению элемента в периодической системе можно определить его принадлежность к металлам или неметаллам, а также свойства образованных им высших оксида и гидроксида. Элементы главных подгрупп, лежащие выше диагонали Be-At, относятся к неметаллам. Остальные элементы – металлы. При этом металлические свойства слева направо по периоду ослабевают, а сверху вниз по группе усиливаются.
Таким образом, калий – металл. Его металлические свойства выражены сильнее, чем у натрия и кальция.
3. Формула и свойства высшего оксида и гидроксида элемента
Если элемент образует простое вещество-металл, то его высший оксид и гидроксид будут основными. Если неметалл – то кислотными. Если переходный металл – то амфотерными (Рис. 2).
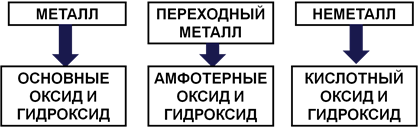
Рис. 2. Связь свойств элементов и образованных ими соединений
Так как калий – металл, его высший оксид и гидроксид будут проявлять основные свойства.
Составим формулы высшего оксида и гидроксида калия. Высшая валентность калия равна I, значит, формула высшего оксида – К2О, его характер – основный.
Основному оксиду соответствует основание – КОН.
Можно подтвердить основный характер оксида и гидроксида калия, записав уравнения реакций этих веществ с кислотой:
K2O + 2HCl = 2KCl + H2O
KOH + HCl = KCl + H2O
Элементы-неметаллы могут образовать летучие водородные соединения. Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – NH3 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.
Если сравнивать калий с соседними по подгруппе и периоду элементами, то можно сказать, что основные свойства его оксида и гидроксида будут ярче выражены, чем у оксидов и гидроксидов натрия и кальция. Рубидий – более активный металл, чем калий. Значит, основные свойства его оксида и гидроксида будут выражены сильнее, чем у оксида и гидроксида калия.
Характеристика элемента по плану
Охарактеризуем по плану химический элемент серу, учитывая ее положение в Периодической системе элементов Д.И. Менделеева:
1. Химический знак – S («Эс»)
2. Порядковый номер – 16, VI группа, А подгруппа, 3 период
3. Строение атома:
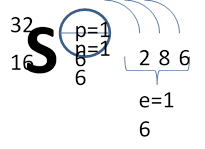
4. Свойства простого вещества: S – неметалл
5. Высшая и низшая валентность: VI и II
6. Высший оксид: SO3 (кислотный)
Высший гидроксид: H2SO4 (кислота)
7. Формула летучего водородного соединения: H2S
