Периодический закон и Периодическая система химических элементов
1. Открытие Периодического закона
Многие химики предлагали различные варианты классификации химических элементов. При этом они использовали один из двух подходов к построению системы:
1. Объединение элементов в группы по сходству состава и свойств образованных ими веществ.
2. Расположение химических элементов в порядке увеличения их атомной массы.
Но ни один, ни другой подход не привели к созданию системы, объединяющей все элементы.
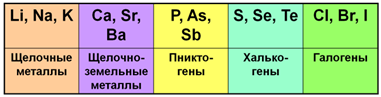
Рис. 1. Некоторые естественные семейства элементов

Рис. 2. Д. И. Менделеев
Проблема систематизации химических элементов заинтересовала молодого 35-летнего профессора Педагогического университета Д.И. Менделеева. В 1869 году он работал над созданием учебника для студентов «Основы химии». Ученый хорошо понимал, что для того чтобы студенты лучше разобрались в разнообразии свойств химических элементов, эти свойства нужно систематизировать.
Д.И. Менделеев решил использовать оба подхода построения системы элементов. Он считал, что атомная масса предопределяет все остальные свойства элементов, но понимал, что место элемента в системе должно определяться с учетом валентности и свойств элемента.
К 1869 году было известно 63 химических элемента, для многих из которых были неверно определены относительные атомные массы. В результате кропотливой работы по исправлению атомных масс и валентности элементов, а также по выяснению места еще не открытых химических элементов Д.И. Менделеев открыл закон, который назвал Периодическим законом. Формулировка этого закона с использованием современной терминологии звучит так:
Свойства элементов и состав и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от величин их относительных атомных масс.
2. Структура Периодической таблицы элементов
На сегодняшний день открыто 118 химических элементов, каждый из которых занял свою ячейку в Периодической системе. Новые открываемые элементы имеют большую относительную атомную массу, чем уже известные и попадают в конец таблицы. В настоящее время используются длинная и короткая формы периодических таблиц.
В ячейке таблицы записывается символ химического элемента, его название и порядковый номер, значение относительной атомной массы.
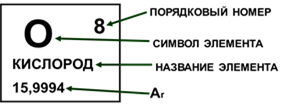
Рис. 3. Информация о химическом элементе кислороде
При изучении школьного курса химии, как правило, пользуются короткой формой Периодической таблицы. Она содержит 8 вертикальных столбцов (групп), которые нумеруются римскими цифрами. Каждая группа включает в себя главную (А) и побочную (В) подгруппы.
У элементов главных подгрупп высшая валентность, как правило, равна номеру группы. Одними из исключений этого правила являются кислород (его валентность всегда равна II) и фтор (высшая валентность которого – I).
С помощью Периодической таблицы можно определить и низшую валентность элемента. Для этого из 8 (максимального числа групп) надо вычесть номер группы, в которой находится элемент. Например, высшая валентность фосфора равна V (т. к. фосфор находится в V группе), а низшая равна III. Только это правило применимо для элементов главных подгрупп V–VII групп.
Горизонтальные ряды химических элементов в Периодической таблице называются периодами. Пока их 7. Первые три периода называют малыми (первый период содержит всего 2 хим. элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
По положению элемента в Периодической системе можно определить его принадлежность к металлам или неметаллам. Для этого в короткой форме таблицы нужно провести диагональ от бериллия к астату. Элементы главных подгрупп, находящиеся выше этой диагонали (плюс водород), относятся к неметаллам. Все остальные элементы – металлы. Инертные газы He, Ne, Ar, Kr, Xe, Rn не относят ни к металлам, ни к неметаллам.
В длинной форме таблицы можно провести диагональ от бора к астату. Все элементы, которые находятся ниже этой диагонали, образуют простые вещества металлы.
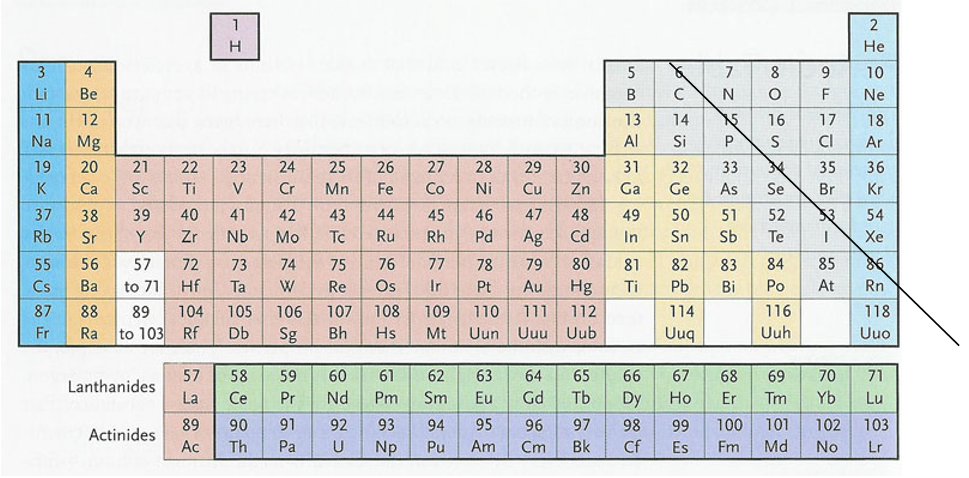
Рис. 4. Длинная форма периодической системы химических элементов
По положению элемента в периодической системе можно получить информацию о его высшем оксиде и гидроксиде. У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (Рис. 5).
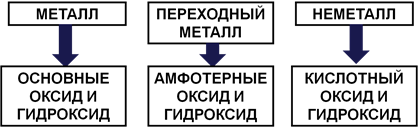
Рис. 5. Связь свойств элементов и образованных ими соединений
