1. Даны формулы веществ: O3, S4, CaCO3, Na, H3PO4, Р4, NaOH. Число формул простых веществ и формула вещества с наибольшей молекулярной массой
A) 4 и Р4
=B) 4 и S4
C) 3 и Н3РO4
D) 3 и NaOH
E) 3 и СаСO3
2. Ядро атома радона - 222, Rn содержит
A) 86 протонов, 222 нейтрона
B) 222 протона, 86 нейтронов
C) 136 протонов, 86 нейтронов
=D) 86 протонов, 136 нейтронов
E) 86 протонов, 86 нейтронов
3. Процесс окисления
A) Сl+7 --> Сl-1
=B) N-3 --> N+2
C) Сu+2 --> Сu0
D) О0 --> О-2
E) Fe3+ --> Fе+2
4. Относительная плотность воздуха по водороду
A) 12,5
=B) 14,5
C) 16
D) 21
E) 15,4
5. Валентность фосфора в продукте реакции X: Р2O5+ЗН2O -->2Х
A) VI
B) II
=C) V
D) III
E) IV
6. Из предложенных схем возможна реакция
=A) Са + NiSO4
B) ZnSO4 + Сr
C) Сu + MgCl2
D) Pb(NO3)2 + Ag
E) MgCl2 + Fe
7. Оба вещества содержат пи-связи в группе
A) С2Н6, С2Н2
B) С6Н6, С4Н10
=C) СН3СОН, С2Н4
D) СН3СООН, С2Н6
E) С2Н5ОН, С2Н5Сl
8. Масса 1 моль продукта полного нитрования этилбензола
A) 239 г.
B) 244 г.
C) 240 г.
D) 238 г.
=E) 241 г.
9. Фенол обладает свойствами
=A) Слабых кислот
B) Сильных кислот
C) Амфотерными
D) Восстановителя
E) Оснований
10. Термохимическое уравнение реакции СО(г) + 1/2O2(г) = СO2(г) + 282 кДж. Количество выделившейся теплоты, если в реакцию вступило 56 л (н.у) кислорода равно
A) 282 кДж
B) 846 кДж
C) 1128 кДж
=D) 1410 кДж
E) 564 кДж
11. Если на 53,4 г хлорида алюминия подействовать 64 г гидроксида натрия, то продуктом взаимодействия будет
A) 47,2 г А1(ОН)3
B) 23,6 г Na[Al(OH)4]
C) 15,6 г А1(ОН)3
=D) 47,2 г Na[Al(OH)4]
E) 64,4 г А1(ОН)3
12. Масса и состав полученной соли, если оксид углерода (IV) объёмом 5,6 л (н.у) прореагировал без остатка с 500 г 2% раствора гидроксида натрия
A) 26,5 г NaHCO3
B) 53 г Na2CO3
C) 106 г Na2CO3
=D) 21 г NaHCO3
E) 10,5 г NaHCO3
13. Вещество А в цепи превращения: H2S—>SO2—>А—>H2SO4—>SO2
A) Сульфат натрия
=B) Оксид серы (VI)
C) Сера
D) Сульфид натрия
E) Сероводород
14. На мрамор массой 40 г, воздействовали избытком соляной кислоты. Выделился газ объемом (н.у.)
A) 4,56 л
=B) 8,96 л
C) 3,36 л
D) 5,56 л
E) 12,34 л
15. Объем бутана (н.у.), при сжигании которого выделилось 134,4 л углекислого газа
A) 19,6л
B) 21,6 л
C) 22,6 л
=D) 33,6 л
E) 44,6 л
16. Объем ацетилена (м3, н.у.), который получен из 4 кг карбида кальция, содержащего 20% примесей
A) 6,12
B) 2,12
C) 4,12
D) 5,12
=E) 1,12
17. Массовая доля выхода эфира, если получено 2,7 г метилформиата при нагревании метанола массой 2,76 г муравьиной кислоты
=A) 75 %
B) 76 %
C) 65 %
D) 81 %
E) 69 %
18. Конечный продукт в следующей схеме превращения
A) 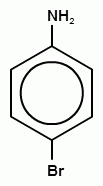
B) 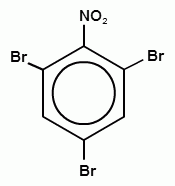
C) 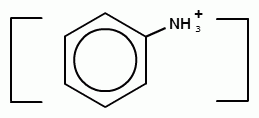
D) 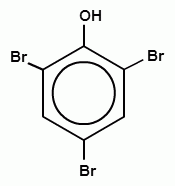
=E) 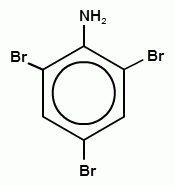
19. В схеме превращений: С--> СН4 --> С2Н2 --> С6Н6--> C2H5NO3. Правильная последовательность добавления реагентов, это
=A) Н2; t°C; t°C, акт.С; HNO3;
B) t°C; HNO3; Н2; HNO3;
C) t°C, kat; Н2O; НС1; Вr2;
D) Н2; t°С; Н2O; КОН (спирт);
E) Н2; Н2O; HNO3; Н2;
20. Из известняка массой 300 кг с массовой долей карбоната кальция 90 % получена известь. Объем воды ( в 3-х кратном размере) для гашения извести равен
A) 14,58 л
B) 87 л
C) 8,72 л
D) 140,58 л
=E) 145,8 л
21. Объем (мл) 2%-ной хлороводородной кислоты с плотностью 1 г/мл, необходимый для нейтрализации 100 мл 1М раствора гидроксида бария
A) 235 мл
B) 335 мл
C) 175 мл
D) 225 мл
=E) 365 мл
22. Объем 0,2 М раствор соляной кислоты, необходимого для нейтрализации раствора, полученного при обработке 4,6 г натрия избытком воды
A) 0,5 л
=B) 1 л
C) 0,75 л
D) 1,5 л
E) 0,25 л
23. При обработке смеси меди и железа концентрированной азотной кислотой, выделилось 1,12л газа. А при действии на эту же смесь соляной кислотой - 0,56 л газа. Масса смеси
A) 11 г
B) 2,8 г
C) 6 г
=D) 3 г
E) 4 г
24. При взаимодействии уксусной кислоты со 120 мл 90 %-ного метанола (плотность 0,7 г/см3 ) получили сложный эфир массой
A) 87,4 г
B) 21,8 г
C) 43,7 г
D) 10,9 г
=E) 174,8 г
25. 36 г глюкозы подверглось спиртовому брожению. Газ, полученный при этом, полностью поглотился 80 г 10 %-ого раствора едкого натра. Молярная масса полученной соли
=A) 84 г/моль
B) 106 г/моль
C) 90 г/моль
D) 47 г/моль
E) 53 г/моль
