Амфотерные гидроксиды
1. Понятие «амфотерность»
С греческого языка слово «amphoteros» переводится как «тот и другой». Амфотерность – это двойственность кислотно-основных свойств вещества. Амфотерными называют гидроксиды, которые в зависимости от условий могут проявлять как кислотные, так и основные свойства.
2. Состав и свойства амфотерных гидроксидов
Примером амфотерного гидроксида может служить гидроксид цинка. Формула этого гидроксида в основной форме – Zn(OH)2. Но можно записать формулу гидроксида цинка в кислотной форме, поставив на первое место атомы водорода, как в формулах неорганических кислот: H2ZnO2 (Рис. 1). Тогда ZnO22- будет кислотным остатком с зарядом 2-.
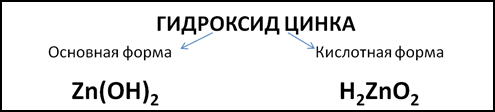
Рис. 1. Формулы гидроксида цинка
Особенностью амфотерного гидроксида является то, что в нем мало различаются по прочности связи О-Н и Zn-O. Отсюда и двойственность свойств. В реакциях с кислотами, готовыми отдать катионы водорода, гидроксиду цинка выгодно разрывать связь Zn-O, отдавая ОН-группу и выступая в роли основания. В результате таких реакций образуются соли, в которых цинк является катионом, поэтому их называют солями катионного типа:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
(основание)
В реакциях со щелочами гидроксид цинка выступает в роли кислоты, отдавая водород. При этом образуются соли анионного типа (цинк входит в состав кислотного остатка – аниона цинката). Например, при сплавлении гидроксида цинка с твердым гидроксидом натрия образуется Na2ZnO2 – средняя соль анионного типа цинкат натрия:
H2ZnO2 + 2NaOH(ТВ.) = Na2ZnO2 + 2H2O
(кислота)
При взаимодействии с растворами щелочей амфотерные гидроксиды образуют растворимые комплексные соли. Например, при взаимодействии гидроксида цинка с раствором гидроксида натрия образуется тетрагидроксоцинкат натрия:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
[Zn(OH)4]2- – сложный анион, который принято заключать в квадратные скобки.
Таким образом, амфотерность гидроксида цинка обусловлена возможностью существования ионов цинка в водном растворе в составе как катионов, так и анионов. Состав этих ионов зависит от кислотности среды. В щелочной среде устойчивы анионы ZnO22-, а в кислотной среде устойчивы катионы Zn2+.
Амфотерные гидроксиды – нерастворимые в воде вещества, и при нагревании они разлагаются на оксид металла и воду:
Zn(OH)2 = ZnO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
Степень окисления металла в гидроксиде и оксиде должна быть одинаковой.
3. Получение амфотерных гидроксидов
Амфотерные гидроксиды – нерастворимые в воде соединения, поэтому их можно получить по реакции обмена между раствором соли переходного металла и щелочью. Например, гидроксид алюминия образуется при взаимодействии растворов хлорида алюминия и гидроксида натрия:
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
При сливании данных растворов образуется белый желеподобный осадок гидроксида алюминия (Рис. 2).
Но при этом нельзя допустить избытка щелочи, ведь амфотерные гидроксиды растворяются в щелочах. Поэтому вместо щелочи лучше использовать водный раствор аммиака. Это слабое основание, в котором гидроксид алюминия не растворяется. При взаимодействии хлорида алюминия с водным раствором аммиака образуется гидроксид алюминия и хлорид аммония:
AlCl3+ 3NH3• H2O = Al(OH)3↓ + 3NH4Cl

Рис. 2. Образование осадка гидроксида алюминия
