Классификация и номенклатура неорганических веществ
1. Простые и сложные вещества
Неорганические вещества по составу принято делить на две группы: немногочисленную группу простых веществ (их насчитывается около 400) и очень многочисленную группу сложных веществ. Простые вещества состоят из одного химического элемента, а сложные – из нескольких.
2. Классификация простых веществ
Все простые вещества можно разделить на металлы и неметаллы, поскольку их свойства существенно отличаются. Металлы обладают металлическим блеском, высокой тепло- и электропроводностью, пластичны, проявляют восстановительные свойства. Неметаллы обладают очень разными физическими и химическими свойствами, но, как правило, в твердом состоянии хрупкие, плохо проводят электрический ток и тепло.
Граница между металлами и неметаллами условна. Существуют вещества, обладающие свойствами как металлов, так и неметаллов. Например, серый мышьяк имеет металлический блеск и электрическую проводимость (рис. 1), а другая аллотропная модификация – желтый мышьяк – имеет чисто неметаллические свойства.

Рис. 1. Серый мышьяк
3. Классы сложных веществ
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли (Рис. 2). Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
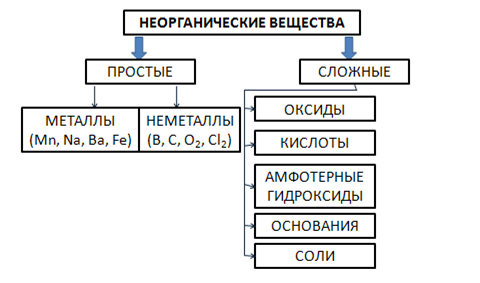
Рис. 2. Классификация неорганических веществ
Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
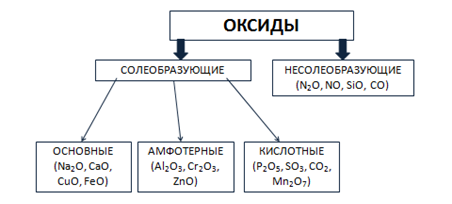
Рис. 3. Классификация оксидов
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, H2SO4, H3PO4) и бескислородные (HI, H2S). Рис. 4.
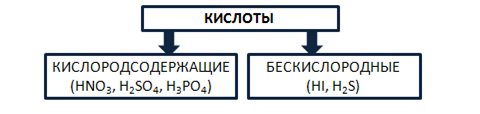
Рис. 4. Классификация кислот
Основания – это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-анионов. В основу классификации оснований могут быть положены разные признаки. Например, их отношение к воде. По данному признаку основания делят на растворимые в воде (щелочи) и нерастворимые в воде. Рис. 5.
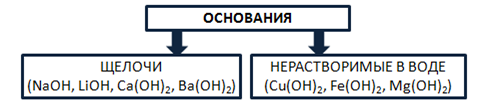
Рис. 5. Классификация оснований
Амфотерные гидроксиды – это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = H2ZnO2
форма основания форма кислоты
Существует несколько видов солей (рис. 6).
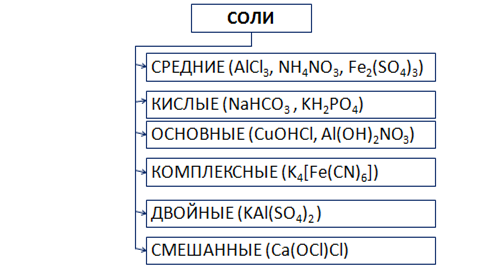
Рис. 6. Виды солей
Средние соли состоят из катионов металла (или аммония) и анионов кислотных остатков. Кислые соли, кроме катионов металла, содержат катионы водорода и анион кислотного остатка. Основные соли в своем составе содержат гидроксид-анионы.
Если соль образована двумя видами катионов металлов и одним анионом, то ее называют двойной. Например, сульфат алюминия-калия KAl(SO4)2.
Соли с двумя разными анионами и одним катионом называют смешанными. Например, Са(OCl)Cl – хлорид-гипохлорит кальция.
В комплексных солях содержится сложный ион, который принято заключать в квадратные скобки.
