Обобщение темы "Химия металлов"
1. Связь внутреннего строения металлов с их свойствами
Что общего в строении атомов металлов? Для ответа на этот вопрос нужно вспомнить, где располагаются металлы в Периодической системе. В большинстве своем, металлы расположены в левой и нижней части таблицы Менделеева, т.е. в основном в I, II и III группах. Поэтому для элементов-металлов характерны относительно большие радиусы и малое число внешних электронов (как правило, не более трех).
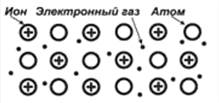
Такое строение атомов металлов объясняет их большую восстановительную активность, они легко превращаются в катионы. Оторвавшиеся от атомов электроны свободно перемещаются между катионами металлов, возникает металлическая связь. Металлической называют связь между ион-атомами металлов и делокализованными электронами. Кристаллическую решетку металлов называют металлической.
Рис. 1. Модель кристаллической решетки металла
Особое строение металлической кристаллической решетки обуславливает общие свойства металлов. Они по-особому блестят, обладают пластичностью, высокой тепло- и электропроводностью. Все металлы проявляют восстановительные свойства. Причем восстановительная активность, как правило, усиливается сверху вниз по группе и справа налево по периоду.
2. Химические свойства металлов
Металлы реагируют со многими неметаллами, в частности с галогенами, кислородом и серой. В результате протекают реакции соединения. Металлы в этих превращениях выступают в роли восстановителей.
Например, при взаимодействии кальция с хлором образуется хлорид кальция:
Ca + Cl2 = CaCl2
При взаимодействии магния с кислородом, образуется оксид магния:
2Mg + O2 = 2MgO
При взаимодействии калия с серой образуется сульфид калия:
2K + S = K2S
Нужно помнить, что скорость протекания данных реакций зависит от активности металла (от его природы).
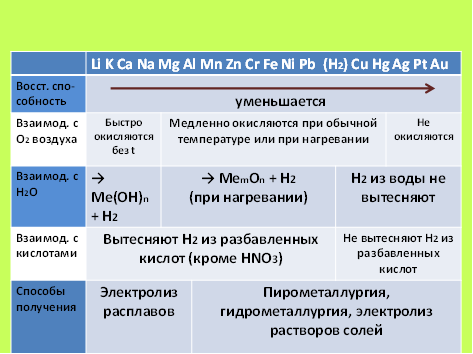
Например, кислородом воздуха при обычных условиях быстро окисляются только металлы, стоящие в ряду активности до магния. Это щелочные и щелочноземельные металлы. Большинство же металлов окисляется кислород воздуха медленно или только при нагревании. Серебро, золото и платина кислородом воздуха не окисляются.
Вам также известны реакции металлов с водой, кислотами и растворами солей.
Наиболее активные металлы взаимодействуют с водой при обычных условиях (без нагревания) с образованием гидроксидов и водорода. Металлы, стоящие в ряду активности между алюминием и водородом, взаимодействуют с водой при нагревании с образованием оксидов и водорода. Металлы, стоящие за водородом, водород из воды не вытесняют.
Взаимодействие металла с раствором соли возможно, если реагирующий металл активнее, чем металл, входящий в состав соли. Например, реакция между сульфатом меди(II) и цинком протекает, т.к. цинк расположен в ряду активности левее меди. В результате образуется сульфат цинка и металлическая медь. А вот медь с раствором сульфата цинка взаимодействовать не будет, т.к. медь – мене активный металл, чем цинк.
Zn + CuSO4 = Cu + ZnSO4
Cu + ZnSO4 → реакция не идет
Металлы, стоящие в ряду активности левее водорода, способны вытеснять водород из растворов кислот. Исключение составляет разбавленная азотная кислота. Даже в разбавленном виде эта кислота обладает сильными окислительными свойствами и способна окислять даже малоактивные металлы, причем в этих реакциях водород, как правило, не выделяется.
3. Способы получения металлов
Наиболее активные металлы получают электролизом расплавов их соединений. Менее активные металлы восстанавливают из их оксидов углем, оксидом углерода(II), водородом или алюминием, а сульфиды металлов вначале обжигают. Такие методы получения металлов называют пирометаллургией. Некоторые металлы получают из растворов их солей методами гидро- или электрометаллургии.
Закономерности, отраженные в таблице 1, условные. Однако эта таблица помогает ориентироваться в некоторых химических процессах.
Таблица 1. Химические свойства и способы получения металлов