Электронные оболочки атома. Атомные модели Бора
Постулаты Н. Бора
Атомное ядро состоит из протонов – положительно заряженных частиц и нейтронов – частиц, не имеющих заряда. На этом уроке мы рассмотрим строение электронной оболочки атома.
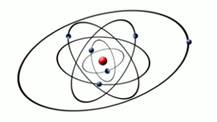
Рис. 1. Планетарная модель атома
В 1913 году датский физик Нильс Бор предположил, что атом по строению похож на строение солнечной системы. Внутри атома, также как и внутри солнечной системы солнце находится массивное ядро, в котором сосредоточена вся масса атома. А вокруг этого ядра, как и планеты вокруг солнца, вращаются электроны. Рис.1. Электрон имеет массу в 1832 раза меньшую, чем протон или нейтрон. Модель Нильса Бора была основана на модели его учителя Эрнеста Резерфорда.
Нильс Бор предположил, что электроны в атоме не хаотично движутся, а движутся по определенным орбитам. Он постулировал, то есть принял без доказательства два положения.
Постулаты Нильса Бора
1. В атоме существуют орбиты, находясь на которых, электрон не излучает энергию. Эти орбиты называются стационарными.
2. Излучение происходит только при перескоке электрона с одной стационарной орбиты на другую.
Строение электронной оболочки атома
Согласно квантовой теории строения атома, все электроны в атоме движутся по энергетическим уровням или орбитам. Эти уровни состоят из подуровней. В свою очередь подуровни состоят из атомных орбиталей. Такое строение легко себе представить, если предположить, что электронная оболочка атома – это дом, который стоит на ядре. Дом состоит из многих этажей – уровней. Каждый уровень имеет подуровни – это квартиры. В квартирах есть атомные орбитали, т.е. комнаты. Мы может определить не конкретное местонахождение электрона на орбиталях, а определить вероятность его нахождения на атомных орбиталях.
Уровни
Электронные орбиты в модели Бора обозначаются целыми числами:1, 2, 3, 4,… и так до n, или латинскими буквами по алфавиту, начиная с буквы K, L, M, N, O P, Q. Начиная от ближайшего к ядру уровня. В дальнейшем мы будем называть такие орбиты - уровни.
Подуровни.
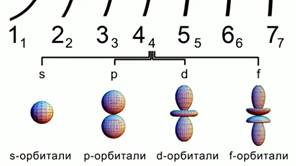
Рис. 2. Формы атомных орбиталей
Уровни в свою очередь состоят из подуровней. Число подуровней на каждом уровне равно номеру уровня. Подуровни имеют названия.
1ый подуровень каждого уровня называется S,
2-ой подуровень каждого уровня называется P,
3-ий подуровень каждого уровня называется d,
4-ий подуровень каждого уровня называется f
Орбитали существуют разной формы.
s- орбиталь сферической формы, p-орбиталь имеет форму объёмной восьмерки.d и f –орбитали еще более сложной формы. Рис 2.
Все эти фигуры очерчивают область наибольшей вероятности нахождения электронов в атоме.
Волновая модель атома – это не физическая модель, а скорое абстрактная или математическая модель строения атома, расположения электронов в нем.
S – элементы.
Это элементы, которые на внешнем уровне содержать только s –электроны.
Если это р – электроны, то тогда это р – элемент.
Чем дальше энергетический уровень расположен от ядра, тем больше на нем может разместиться электронов, потому что каждый последующий энергетический уровень имеет большее количество подуровней. Так на каждом n уровне может быть n2 орбиталей. Следовательно, электронов может разместиться 2n2. Почему мы умножили n2 на 2? Потому что на каждой атомной орбитали может находиться не более 2 х электронов .
Наибольшее число электронов на каждом уровне приведено в таб.1.
|
Электронный уровень (n) |
Сколько может разместиться электронов на данном уровне 2n2 |
|
1 |
2 |
|
2 |
8 |
|
3 |
18 |
|
4 |
32 |
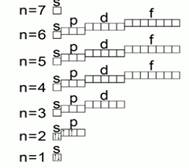
Рис. 3. Орбитальная диаграмма
Все эти сведения нужны нам для того, чтобы научиться расселять электроны по атомным уровням, подуровням и по орбиталям.
Квантовая диаграмма
Существует условное изображение электронных уровней и подуровней. Это орбитальная или квантовая диаграмма. На такой диаграмме орбитали условно изображаются квадратиками, а электроны стрелочками. Рис. 3. Если в одной клеточке находится две стрелочки, то они будут обозначены стрелочками, направленными в разные стороны. Это свойство электронов называется спином.
После того, как вы заполнили все атомные орбитали электронами, вы должны написать «электронный паспорт» элемента или его электронную формулу. Для этого нужно обозначить каждый энергетический уровень цифрой 1, 2, 3,…, подуровень буквой s, p, d…
В качестве степени выносите число электронов на данном подуровне.
Электронное строение атома азота
Пример №1.
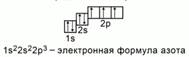
Рис. 4. Электронная формула азота
Запишите электронную формулу химического элемента с порядковым номером 7.
В атоме такого элемента должно быть 7 электронов. Заполним электронами орбитали, начиная с нижнего 1s.
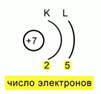
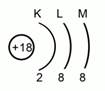
Рис. 5. Схема расположения электронов в атоме
Получится такая электронная конфигурация: 1s22s22p3.Рис.4.
После этого нужно зафиксировать расположение электронов по энергетическим уровням. Для этого нужно схематично изобразить ядро, указать его заряд и определить число энергетических уровней. Напомню, что у азота их всего 2. Рисуем 2 дуги, а под этими дугами пишем число электронов, которые располагаются на них. Тогда мы получим такую схему электронного расположения в атоме. Рис.5.
Электронное строение атома аргона
Пример №2.
Запишите электронную формулу химического элемента с порядковым номером 18.
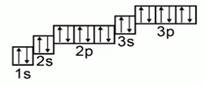
Действуя также как и в первом случае, мы расположим электроны по атомным орбиталям. 1s22s22p63s23p6. Это элемент аргон. Рис.6. В переводе с греческого «недеятельный». Это название он получил, потому что не вступает в взаимодействие ни с одним химическим элементом.
|
|
|
|
Рис. 6. Электронная конфигурация аргона
Элементы с завершенной внешней электронной оболочкой.
Входит в подгруппу благородных или инертных газов. Их инертность вызвана строением их атома. Эти газы имеют завершенную внешнюю энергетическую оболочку – ns2np6. Инертные газы образуют одноатомную молекулу. Все остальные газы в природе имеют только двухатомную молекулу. Например, О2, Н2.причина устойчивости химических элементов с завершенной электронной оболочкой пока не ясна. Но химики воспринимают это просто как закон природы. Все другие элементы будут стремиться к завершению своей внешней электронной оболочки.
Этимология обозначений электронных орбиталей
Интересно будет узнать, почему подуровни определенных уровней названы определенными буквами английского алфавита. Любой атом испускает энергию. Эту энергию можно зафиксировать в спектрах испускания атомов. Различные спектры испускания атомов имеют различный вид. Их линии различаются друг от друга. Так наиболее узкие резкие линии были названы буквой s. От английского слова «шар».
s- подуровень назван по «резкой» (sharp) линии
p- подуровень назван по «главной» (principal) линии
d- подуровень назван по «диффузной», «размытой» (diffuse) линии
f- подуровень назван по «фундаментальной» (fundamental) линии
Некоторые сведения об инертных газах


Из-за своей химической инертности благородные газы долго не были известны в химии. Только в 1892 году был получен первый инертный газ аргон. Он был получен Д. Рэлеем. Получил он его при опытах с азотом. Д. Рэлей заметил, что если получать азот из воздуха, то этот газ азот будет иметь массу большую, чем, если получать азот при различных химических опытах. Если 1 литр азота получить из воздуха, то он будет иметь массу 1,2572 г, а если получить азот при разложении азотистых соединений, то масса будет 1,2505 г. Откуда же берется такая разность? Многие ученые подумали, что они просто провели опыт и перестали взвешивать воздух, полученный таким путем. Д. Рэлей со своим другом У. Рамзаем. Провели множество опытов и подтвердили, что газ азот, полученный из воздуха содержит в своем составе еще какой-то газ , который был в 20 раз тяжелее водорода. Так впервые был выделен аргон. До 60-х годов XX столетия ни одно соединение инертных газов не было получено. Сейчас научились получать искусственно соединения инертных газов с фтором и кислородом. Если разобрать обычную лампочку накаливания, то вы столкнетесь с газом аргоном. Но делать этого не следует, потому что вы можете пораниться.
Подведение итога
Вы узнали об электронных оболочках атома, что такое атомные модели Бора. Вы повторили строение атомного ядра, рассмотрели современные взгляды при изучении электронных оболочек атома, условные изображения электронных уровней и подуровней. Рассмотрели атомные модели Бора. Более подробно строение ядра мы рассмотрим на уроках химии в 11 классе.