Описание элемента по положению в Периодической системе элементов Д.И. Менделеева
1. Какие характеристики атома меняются в Периодической системе периодически

В 1869 году Д.И.Менделеев на основе данных накопленных о химических элементах сформулировал свой периодический закон. Тогда он звучал так: « Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов». Очень долго физический смысл закона Д.И.Менделеева был непонятен. Всё встало на свои места после открытия в XX веке строения атома.
Современная формулировка периодического закона: « Свойства простых веществ, также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома».
Заряд ядра атома равен числу протонов в ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом, атом электронейтрален.
Заряд ядра атома в Периодической таблице – это порядковый номер элемента.
Номер периода показывает число энергетических уровней, на которых вращаются электроны.
Номер группы показывает число валентных электронов. Для элементов главных подгрупп число валентных электронов равно числу электронов на внешнем энергетическом уровне. Именно валентные электроны отвечают за образование химических связей элемента.
Химические элементы 8 группы – инертные газы имеют на внешней электронной оболочке 8 электронов. Такая электронная оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю электронную оболочку до 8 электронов.
Какие же характеристики атома меняются в Периодической системе периодически?
- Повторяется строение внешнего электронного уровня.
- Периодически меняется радиус атома. В группе радиус увеличивается с увеличением номера периода, так как увеличивается число энергетических уровней. В периоде слева направо будет происходить рост атомного ядра, но притяжение к ядру будет больше и поэтому радиус атома уменьшается.
- Каждый атом стремится завершить последний энергетический уровень У элементов 1 группы на последнем слое 1 электрон. Поэтому им легче его отдать. А элементам 7 группы легче притянуть 1 недостающий до октета электрон. В группе способность отдавать электроны будет увеличиваться сверху вниз, так ка увеличивается радиус атома и притяжение к ядру меньше. В периоде слева направо способность отдавать электроны уменьшается, потому что уменьшается радиус атома.
- Чем легче элемент отдает электроны с внешнего уровня, тем большими металлическими свойствами он обладает, а его оксиды и гидроксиды обладают большими основными свойствами. Значит, металлические свойства в группах увеличиваются сверху вниз, а в периодах справа налево. С неметаллическими свойствами все наоборот.
2. Описание элемента магния, астата, хлора

Рис. 1. Положение магния в таблице
В группе магний соседствует с бериллием и кальцием. Рис.1. Магний стоит ниже, чем бериллий, но выше кальция в группе. У магния больше металлические свойства, чем у бериллия, но меньше чем у кальция. Основные свойства его оксидов и гидроксидов изменяются также. В периоде натрий стоит левее, а алюминий правее магния. Натрий будет проявлять больше металлические свойства, чем магний, а магний больше, чес алюминий. Таким образом, можно сравнить любой элемент с соседями его по группе и периоду.
Кислотные и неметаллические свойства изменяются противоположно основным и металлическим свойствам.
3. Описание элемента хлора
Характеристика хлора по его положению в периодической системе Д.И.Менделеева.

Рис. 4. Положение хлора в таблице
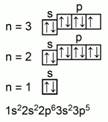
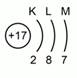
![]() . Значение порядкового номера 17 показывает число протонов17 и электронов17 в атоме. Рис.4. Атомная масса 35 поможет вычислить число нейтронов (35-17 = 18). Хлор находится в третьем периоде, значит число энергетических уровней в атоме равно 3. Стоит в 7 –А группе, относится к р- элементам. Это неметалл. Сравниваем хлор с его соседями по группе и по периоду. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона. Хлор обладает меньшими неметаллическими свойствами, чем фтор и большими чем бром. Распределим электроны по энергетическим уровням и напишем электронную формулу. Общее распределение электронов будет иметь такой вид. См.Рис. 5
. Значение порядкового номера 17 показывает число протонов17 и электронов17 в атоме. Рис.4. Атомная масса 35 поможет вычислить число нейтронов (35-17 = 18). Хлор находится в третьем периоде, значит число энергетических уровней в атоме равно 3. Стоит в 7 –А группе, относится к р- элементам. Это неметалл. Сравниваем хлор с его соседями по группе и по периоду. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона. Хлор обладает меньшими неметаллическими свойствами, чем фтор и большими чем бром. Распределим электроны по энергетическим уровням и напишем электронную формулу. Общее распределение электронов будет иметь такой вид. См.Рис. 5
|
|
|
Рис. 5. Распределение электронов атома хлора по энергетическим уровням
Определяем высшую и низшую степень окисления хлора. Высшая степень окисления равна +7, так как он может отдать с последнего электронного слоя 7 электронов. Низшая степень окисления равна -1, потому что хлору до завершения необходим 1 электрон. Формула высшего оксида Cl2O7 (кислотный оксид), водородного соединения HCl.
4. Степень окисления
В процессе отдачи или присоединения электронов атом приобретает условный заряд. Этот условный заряд называется степенью окисления.
- Простые вещества обладают степенью окисления равной нулю.
- Элементы могут проявлять максимальную степень окисления и минимальную. Максимальную степень окисления элемент проявляет тогда, когда отдает все свои валентные электроны с внешнего электронного уровня. Если число валентных электронов равно номеру группы, то и максимальная степень окисления равна номеру группы.

Рис. 2. Положение мышьяка в таблице
Минимальную степень окисления элемент будет проявлять тогда, когда он примет все возможные электроны для завершения электронного слоя.
Рассмотрим на примере элемента №33 значения степеней окисления.
Это мышьяк As.Он находится в пятой главной подгруппе.Рис.2. На последнем электронном уровне у него пять электронов. Значит, отдавая их, он будет иметь степень окисления +5. До завершения электронного слоя атому As не хватает 3 электрона. Притягивая их, он будет иметь степень окисления -3.
Положение элементов металлов и неметаллов в Периодической системе Д.И. Менделеева.

Рис. 3. Положение металлов и неметаллов в таблице
В побочных подгруппах находятся все металлы. Если мысленно провести диагональ от бора к астату, то выше этой диагонали в главных подгруппах будут все неметаллы, а ниже этой диагонали - все металлы. Рис.3.
Используя Периодическую систему можно очень много сказать об элементе. Можно сравнить его с другими элементами, определить строение его атома, электронной оболочки атома.
5. План характеристики химического элемента
1. Символ элемента
2. Порядковый номер элемента
3. Значение относительной атомной массы элемента.
4. Число протонов, электронов, нейтронов.
5. Номер периода.
6. Номер и тип группы (тип элемента s -, p -,d -,f - элемент)
7. Металл или неметалл
8. Сравнение свойств элемента (металлических и неметаллических) с соседними элементами по периоду и группе.
9. Написать распределение электронов по атомным орбиталям – квантовую диаграмму.
10. Написать электронную формулу.
11. Зарисовать распределение электронов по энергетическим уровням
12. Определить высшую степень окисления атома и формулу его высшего оксида. Определить характер оксида (основной, кислотный, амфотерный).
13. Определить низшую степень окисления элемента и формулу его водородного соединения (если такое есть).
Подведение итога
Вы узнали о Периодическом законе Менделеева, который описывает изменение свойств простых тел, а также формы и свойства соединений элементов в зависимости от величины их атомных масс. Рассмотрели, как по положению в Периодической системе можно описать химический элемент.