Классификация неорганических веществ. Сложные вопросы
1. Классификация солей
В зависимости от состава и химических свойств неорганические вещества делят на классы (Рис. 1). Классификация веществ значительно облегчает процесс их изучения. Зная свойства класса, можно предсказать свойства каждого представителя данного класса.
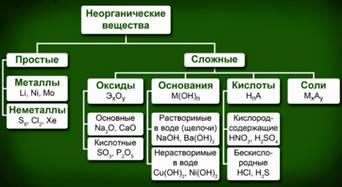
Рис. 1. Классификация неорганических веществ
В зависимости от состава соли делят на несколько групп: средние, кислые и основные (есть и другие группы солей, которые изучают в старших классах).
Средние соли – сложные вещества, состоящие из металла и кислотного остатка. Например, сульфат кальция CaSO4, хлорид алюминия AlCl3, нитрат меди(II) Cu(NO3)2.
В составе кислых солей присутствуют атомы водорода, как и в составе кислот. Атом водорода, входящий в состав кислых солей, обозначается приставкой «гидро-» в названии соли. Например, NaHCO3 – гидрокарбонат натрия (кстати, это вещество еще называют питьевой содой).
В состав основных солей входят гидроксильные группы. Например, Cu(OH)Cl – основная соль. К названиям основных солей прибавляется приставка «гидрокси-». Cu(OH)Cl – гидроксихлорид меди(II).
Любую соль можно рассматривать как продукт взаимодействия между кислотой и основанием. Если все атомы водорода соответствующей кислоты заместятся на атомы металлов из основания, то получится средняя соль. Например:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
сульфат натрия
Если кислота будет взята в избытке и не все атомы водорода в ней заместятся на атомы металла, то образуется кислая соль:
H2SO4 + NaOH = NaНSO4 + H2O
гидросульфат натрия
Основные соли образуются при неполном замещении гидроксогрупп оснований на кислотные остатки. Например:
Mg(OH)2 + HCl = Mg(OH)Cl + H2O
гидроксихлорид магния
2. Виды оксидов
Существуют оксиды, которым не соответствуют ни основания, ни кислоты. Они не образуют солей при взаимодействии с кислотами и щелочами, поэтому такие оксиды называют несолеобразующими или безразличными. Примеры несолеобразующих оксидов: СО, N2O, NO, H2O.
Большинство оксидов относится к группе солеобразующих. Их делят, как правило, на кислотные и основные. Основные оксиды содержат атомы металлов в валентности I, II, реже III, этим оксидам соответствуют основания. Кислотные оксиды – это оксиды неметаллов или металлов в валентности больше IV, этим оксидам соответствуют кислоты.
Основные оксиды взаимодействуют с кислотами с образованием солей:
CaO + 2HCl = CaCl2 + H2O
Кислотные оксиды реагируют с основаниями с образованием солей:
SO2 + 2KOH = K2SO3 + H2O
Поэтому кислотные и основные оксиды называют солеобразующими.
3. Виды бинарных веществ
Существуют неорганические вещества, которые нельзя отнести ни к одному из приведенных в схеме на Рис.1 классов. Приведем примеры.
Нашатырный спирт, использующийся в медицинских целях, – это раствор в воде газа с резким запахом – аммиака. Химическая формула аммиака – NH3. По составу данное вещество больше могло бы соответствовать классу кислот. Однако, водный раствор аммиака окрашивает лакмус в синий цвет, а растворы кислот меняют цвет лакмуса на розовый. Значит, аммиак нельзя отнести ни к одному из перечисленных классов.
Еще одно вещество из домашней аптечки – перекись водорода, или, по-научному, – пероксид водорода. Химическая формула данного вещества – H2O2, его структурная формула – Н-О-О-Н. Как видим, валентность кислорода всегда равна II, а валентность водорода – I. В молекуле пероксида водорода атомы кислорода соединены друг с другом и образуют так называемый «кислородный мостик». Такой «мостик» характерен для отдельной группы веществ – пероксидов, в оксидах он не может присутствовать.
Карбидам, нитридам, силицидам тоже нет места в приведенной классификации. Все эти вещества просто относят к группе бинарных веществ. Примеры бинарных веществ:
СаС2 – карбид кальция
Li3N – нитрид лития
Mg2Si – силицид магния
4. Металлы и неметаллы одновременно
К металлам или неметаллам относится простое вещество олово Sn? Чтобы ответить на этот вопрос, нужно знать, о каком олове идет речь.
Белое олово – серебристо-белый, очень мягкий металл. Используется в пайке, для лужения железа и изготовления сплавов. При низкой температуре белое олово превращается в серый порошок, утрачивая свои металлические свойства. Переход белого олова в серое называют «оловянной чумой» (Рис. 2). Эта «болезнь» металла послужила причиной гибели в 1912 году экспедиции Роберта Скотта к Южному полюсу. Керосин путешественники хранили в сосудах, запаянных оловом, которое при низкой температуре рассыпалось в порошок.

Рис. 2. Переход белого олова в серое
Судя по положению в периодической системе элементов, олово находится примерно на границе «металлы – неметаллы» и действительно обладает двойственными свойствами. Белое олово по физическим свойствам – металл, а другая модификация – серое олово – неметалл.
