Кислотные оксиды
1. Оксиды неметаллов
Вы уже знаете, что все вещества делят на две большие группы – органические и неорганические вещества. В 8 классе изучается классификация неорганических веществ. Вам уже знакомы некоторые группы неорганических веществ – оксиды, хлориды, сульфиды, кислоты и т.д.
Изучение классов неорганических веществ мы начнем с группы веществ, которую называют кислотными оксидами. Многие простые вещества – неметаллы при взаимодействии с кислородом образуют оксиды.
Уголь сгорает в атмосфере кислорода с образованием оксида углерода (IV):
С+О2 = СО2
Фосфор тоже горит в кислороде, при этом образуется оксид фосфора (V):
4P + 5O2 = 2P2O5

Рис. 1. Горение фосфора в кислороде
2. Образование кислот
При растворении полученных оксидов в воде образуются растворы, обладающие общими свойствами. Эти растворы кислые на вкус. В ходе растворения оксида углерода (IV) и оксида фосфора (V) в воде образуются кислоты. Запишем уравнения этих реакций.
При растворении в воде оксида углерода (IV) образуется угольная кислота – Н2СО3:
СO2 + H2O ↔H2CO3
Угольная кислота – нестойкое вещество, она разлагается на исходные вещества. Поэтому правильнее вместо знака равенства поставить знак обратимости в уравнении этой реакции.
Оксид фосфора (V) хорошо растворяется в воде с образованием ортофосфорной кислоты H3PO4:
P2O5+3H2O=2H3PO4
Данные реакции являются реакциями соединения.
3. Кислотные оксиды
Теперь мы можем объяснить происхождение названия химического элемента кислорода. «кислород» - «рождающий кислоты»: при взаимодействии некоторых неметаллов с кислородом образуются оксиды, растворение которых в воде позволяет получить кислоты.
Оксиды, которым соответствуют кислоты, называют кислотными оксидами.
Например, оксид углерода (IV) и оксид фосфора (V) – кислотные оксиды.
Но не все оксиды неметаллов являются кислотными. Есть оксиды неметаллов, которым не соответствуют кислоты. Среди них, оксид углерода (II) или угарный газ - СО, оксиды азота (I) и (II) – N2O, NO. Этим оксидам кислоты не соответствуют.
Есть еще один интересный факт – не все кислотные оксиды взаимодействуют с водой. Например, оксид кремния (IV) не растворяется в воде. Это вещество составляет основу кварца и белого речного песка. Но оксид кремния является кислотным оксидом, т.к. ему соответствует кремниевая кислота H2SiO3. Это стало известно благодаря тому, что кремниевая кислота разлагается на оксид кремния и воду:
H2SiO3 = SiO2 + H2O
К классу кислотных оксидов относятся не только оксиды неметаллов. Кислотные оксиды могут образовать и некоторые металлы с валентностью более III.
Например оксид хрома (VI) является кислотным оксидом, т.к. ем соответствует хромовая кислота H2CrO4. Эту кислоту можно получить при взаимодействии оксида хрома (VI) с водой:
CrO3+H2O=H2CrO4
[00:04:35/Составление формул кислот, соответствующих оксидам]
Не надо заучивать какая кислота какому оксиду соответствует. Чтобы составить формулу кислоты, соответствующей оксиду, надо запомнить несколько правил. Во-первых, валентность химического элемента в оксиде и соответствующей ему кислоте должна быть одинакова.
Валентности элементов в оксиде вы уже умеете определять. Например, в оксиде азота N2O5 валентность азота равна V. Валентности элементов в кислоте, состоящей из трех химических элементов, определить также несложно. Определим валентности элементов в азотной кислоте HNO3.Валентность водорода в кислотах равна I, валентность кислорода равна II. Чтобы найти валентность азота, нужно из общего числа валентностей кислорода вычесть общее число валентностей водорода, т.е. из 6 вычесть 1.
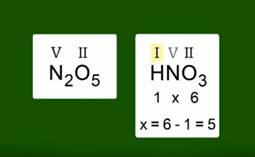
Рис. 2. Валентность азота в N2O5 и HNO3 одинакова и равна V
Формулу кислоты, соответствующей оксиду можно составить, используя реакцию соединения кислотного оксида с водой. Если суммировать атомы одной молекулы оксида и одной молекулы воды, то в большинстве случаев получится формула искомой кислоты.
Рассмотрим два примера. Составим формулы кислот, соответствующих оксиду углерода (IV) и оксиду азота (III). Просуммируем атомы одной молекулы углекислого газа и одной молекулы воды. Получилась формула угольной кислоты H2CO3.
То же проделаем с одной молекулой N2O3 и одной молекулой Н2О. Получили Н2N2O4. В получившейся формуле можно сократить индексы на 2. Получим HNO2 – азотистую кислоту (Рис. 3).
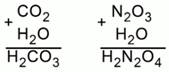
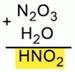
Рис. 3. Составление формул кислот, соответствующих оксидам
Этим правилом нельзя воспользоваться для составления формулы ортофосфорной кислоты. Чтобы ее получить к молекуле оксида фосфора (V) надо прибавить 3 молекулы воды.
