Оксид и гидроксид кальция. Свойства и применение
1. Способы получения оксида кальция
Еще в древние времена люди заметили, что если обжечь известняк, мел или мрамор, то получится белый порошок с особыми свойствами. Основным компонентом мела, мрамора и известняка является вещество, называемое карбонатом кальция. Его химическая формула – СаСО3. При обжиге известняка протекает реакция, уравнение которой:
СаСО3 = СаО + СО2

Рис. 1. Минералы, основу которых составляет карбонат кальция
Оксид кальция может быть получен и при непосредственном сжигании кальция в атмосфере кислорода:
2Са + О2 = 2СаО
При этом протекает реакция соединения кальция с кислородом с образованием оксида кальция.
2. Исторические названия оксида и гидроксида кальция
Свойства образовавшегося оксида кальция используют в строительстве до сих пор. Оксид кальция – это номенклатурное название соединения СаО. Кроме номенклатурного, это вещество имеет несколько исторически сложившихся названий. Как вы уже знаете, оксид кальция можно получить путем обжига известняка, поэтому одно из его исторических названий – обожженная известь.
Если к полученному оксиду кальция добавить воду, то вода зашипит, как будто он раскален. Поэтому обожженная известь получила название «кипелка». При соприкосновении с водой оксид кальция как бы гасится, отдавая теплоту. Поэтому происходящий процесс назвали гашением, а оксид кальция – негашеной известью.
Образующийся при гашении водяной пар разрыхляет негашеную известь, она как бы обрастает пухом. В связи с этим получающаяся при взаимодействии с водой гашеная известь еще стала называться пушонкой.
3. Свойства оксида кальция
Что же происходит при гашении негашеной извести? Установлено, что одна молекула оксида кальция взаимодействует с одной молекулой воды и образуется только одно новое вещество – гашеная известь. Эта реакция относится к типу соединения.
СаО + Н2О = Са(ОН)2
Формулу гашеной извести принято записывать так: Са(ОН)2. Номенклатурное название данного вещества – гидроксид кальция:
4. Использование оксида и гидроксида кальция в строительстве
Смесь гашеной извести и воды называется известковым раствором, который используется в строительстве. Так как гидроксид кальция мало растворим в воде, известковый раствор содержит в себе осадок гидроксида кальция и собственно раствор (известковую воду).
Использование известкового раствора в строительстве для прочного соединения камней связано с его отвердеванием на воздухе.
Таким образом, весь процесс получения и применения оксида кальция можно представить в виде схемы (Рис.2).
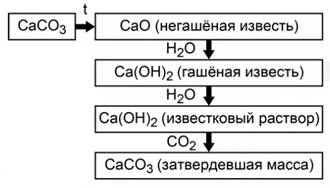
Рис. 2. Получение и применение оксида кальция
При прокаливании карбоната кальция образуется негашеная известь - оксид кальция. При смешении с водой оксид кальция превращается в гашеную известь – гидроксид кальция. Смесь малорастворимого в воде гидроксида кальция и воды называется известковым раствором. При стоянии на воздухе известковый раствор взаимодействует с углекислым газом и превращается снова в карбонат кальция.
Уравнение реакции, соответствующей процессу затвердевания известкового раствора:
Са(ОН)2 + СО2 = СаСО3 + Н2О
Затвердевание известкового раствора происходит потому, что образуется нерастворимое вещество – карбонат кальция.
