Получение кислорода
1. Промышленный способ получения кислорода
В промышленных целях кислород необходимо получать в больших объёмах и максимально дешёвым способом. Такой способ получения кислорода был предложен лауреатом Нобелевской премии Петром Леонидовичем Капицей. Он изобрёл установку для сжижения воздуха. Как известно, в воздухе находится около 21% по объему кислорода. Кислород можно выделить из жидкого воздуха методом перегонки, т.к. все вещества, входящие в состав воздуха имеют разные температуры кипения. Температура кипения кислорода - -183°С, а азота - -196°С. Значит, при перегонке сжиженного воздуха первым закипит и испарится азот, а затем – кислород.
2. Получение кислорода в лаборатории из пероксида водорода
В лаборатории кислород требуется не в таких больших количествах, как в промышленности. Обычно его привозят в голубых стальных баллонах, в которых он находится под давлением. В некоторых случаях всё же требуется получить кислород химическим путём. Для этого используют реакции разложения.
ОПЫТ 1. Нальем в чашку Петри раствор пероксида водорода. При комнатной температуре пероксид водорода разлагается медленно (признаков протекания реакции мы не видим), но этот процесс можно ускорить, если добавить в раствор несколько крупинок оксида марганца(IV). Вокруг крупинок черного оксида сразу начинают выделяться пузырьки газа. Это кислород. Как бы долго ни протекала реакция, крупинки оксида марганца(IV) в растворе не растворяются. То есть, оксид марганца(IV) участвует в реакции, ее ускоряет, но сам в ней не расходуется.
Вещества, которые ускоряют реакцию, но не расходуются в реакции, называют катализаторами.
Реакции, ускоряемые катализаторами, называют каталитическими.
Ускорение реакции катализатором называют катализом.
Таким образом, оксид марганца (IV) в реакции разложения пероксида водорода служит катализатором. В уравнении реакции формула катализатора записывается сверху над знаком равенства. Запишем уравнение проведенной реакции. При разложении пероксида водорода выделяется кислород и образуется вода. Выделение кислорода из раствора показывают стрелкой, направленной вверх:
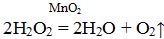
3. Получение кислорода в лаборатории из перманганата калия
В повседневной жизни вы наверняка сталкивались с веществом, которое в быту называется «марганцовкой». Химическое название этого вещества - перманганат калия, его химическая формула KMnO4.
При нагревании перманганат калия разлагается с образованием кислорода.

Рис. 1. Получение кислорода путем термического разложения перманганата калия
ОПЫТ 2. Для опыта нужна пробирка с газоотводной трубкой. В пробирку насыпают кристаллический перманганат калия. При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет.
Уравнение проведенной реакции:
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
