Относительная молярная и молекулярная массы вещества. Молярный объем вещества
Относительная молекулярная масса
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
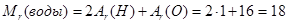
Относительная плотность одного газа по другому
Зная относительные молекулярные массы газообразных веществ, можно сравнивать их плотности, т. е. вычислять относительную плотность одного газа по другому – D(А/Б). Относительная плотность газа А по газу Б равна отношению их относительных молекулярных масс:

Вычислим относительную плотность углекислого газа по водороду:
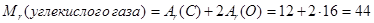
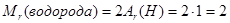 .
.
Теперь вычисляем относительную плотность углекислого газа по водороду:
D(угл. г./водор.) = Mr(угл. г.) : Mr(водор.) = 44:2 = 22.
Таким образом, углекислый газ в 22 раза тяжелее водорода.
Молярная масса
Как известно, закон Авогадро применим только к газообразным веществам. Но химикам необходимо иметь представление о количестве молекул и в порциях жидких или твердых веществ. Поэтому для сопоставления числа молекул в веществах химиками была введена величина – молярная масса.
Молярная масса обозначается М, она численно равна относительной молекулярной массе.
Количество вещества
Отношение массы вещества к его молярной массе называется количеством вещества.
Количество вещества обозначается n. Это количественная характеристика порции вещества, наряду с массой и объемом. Измеряется количество вещества в молях.

Слово «моль» происходит от слова «молекула». Число молекул в равных количествах вещества одинаково.
Экспериментально установлено, что 1 моль вещества содержит 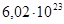 частиц (например, молекул). Это число называется числом Авогадро. А если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.
частиц (например, молекул). Это число называется числом Авогадро. А если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.
Молярная масса измеряется в г/моль. Физический смысл молярной массы в том, что эта масса 1 моль вещества.
Молярный объем
В соответствии с законом Авогадро, 1 моль любого газа будет занимать один и тот же объем. Объем одного моля газа называется молярным объемом и обозначается Vn.
При нормальных условиях (а это 0 °С и нормальное давление – 1 атм. или 760 мм рт. ст. или 101,3 кПа) молярный объем равен 22,4 л/моль.
Тогда количество вещества газа при н.у. можно вычислить как отношение объема газа к молярному объему.

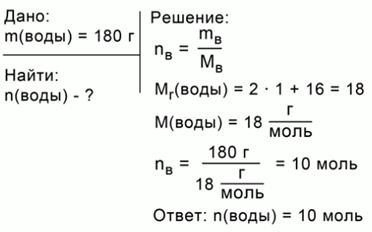
ЗАДАЧА 1. Какое количество вещества соответствует 180 г воды?
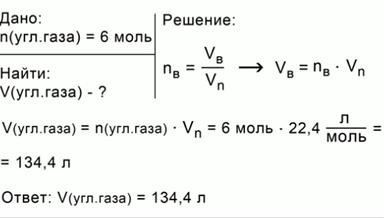
ЗАДАЧА 2. Вычислим объем при н.у., который займет углекислый газ количеством 6 моль.